Hibrit Atomik Orbitaller
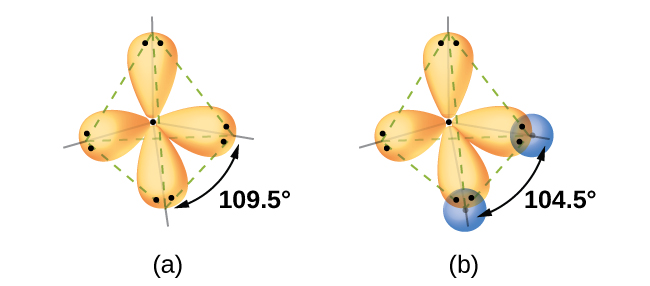
Örtüşen atomik orbitaller açısından düşünmek, iki atomlu moleküllerde kimyasal bağların nasıl oluştuğunu açıklamanın bir yoludur. Bununla birlikte, ikiden fazla atomlu moleküllerin nasıl kararlı bağlar oluşturduğunu anlamak için daha ayrıntılı bir modele ihtiyacımız var. Örnek olarak, iki hidrojen atomuna bir oksijen atomu bağına sahip olduğumuz su molekülünü ele alalım. Oksijen elektron konfigürasyonu 1s22s22p4, iki eşleşmemiş elektronla ( iki 2p orbitalinin her birinde bir tane ). Değerlik bağı teorisi, iki OH bağının, bu iki 2p orbitalinin hidrojen atomlarının 1s orbitalleri ile örtüşmesinden oluştuğunu tahmin eder. Eğer durum böyle olsaydı, Şekil 1'de gösterildiği gibi bağ açısı 90° olurdu, çünkü p orbitalleri birbirine diktir. Deneysel kanıtlar, bağ açısının 90° değil 104,5° olduğunu göstermektedir. Değerlik bağı teorisi modelinin tahmini, bir su molekülünün gerçek dünya gözlemleriyle eşleşmez; Farklı bir modele ihtiyaç var.
Kuantum-mekanik hesaplamalar, gözlemlenen bağ açılarının neden H2O cinsinden olduğunu göstermektedir.Hidrojen atomlarının 1s orbitalinin oksijen atomunun 2p orbitali ile örtüşmesiyle tahmin edilenlerden farklıdır. Dalga fonksiyonu olarak bilinen matematiksel ifade ψ, izole edilmiş bir atomdaki her yörünge ve elektronların dalga benzeri özellikleri hakkında bilgi içerir. Atomlar bir molekülde birbirine bağlandığında, dalga fonksiyonları farklı şekillere sahip yeni matematiksel açıklamalar üretmek için birleşir. Atomik orbitaller için dalga fonksiyonlarını birleştirme işlemine hibridizasyon denir ve matematiksel olarak atomik orbitallerin doğrusal kombinasyonu olan LCAO ile gerçekleştirilir. Ortaya çıkan yeni orbitallere hibrit orbitaller denir. İzole edilmiş bir oksijen atomundaki değerlik orbitalleri, bir 2s orbitali ve üç adet 2p orbitaldir. Bir su molekülündeki bir oksijen atomundaki değerlik orbitalleri farklıdır; yaklaşık olarak bir tetrahedronun köşelerine işaret eden dört eşdeğer hibrit orbitalden oluşurlar ( Şekil 2 ). Sonuç olarak, O ve H orbitallerinin örtüşmesi, bir tetrahedral bağ açısı ( 109.5° ) ile sonuçlanmalıdır. Gözlemlenen 104.5°'lik açı, kuantum-mekanik hesaplamaların yararlı bir açıklama sağladığı deneysel bir kanıttır: Değerlik bağı teorisi, doğru tahminler vermek için bir hibridizasyon bileşeni içermelidir.
Hibridizasyonun anlaşılmasında aşağıdaki fikirler önemlidir:
- İzole edilmiş atomlarda hibrit orbitaller yoktur. Sadece kovalent bağlı atomlarda oluşurlar.
- Hibrit orbitaller, izole edilmiş atomlardaki atomik orbitallerinkinden çok farklı şekillere ve yönelimlere sahiptir.
- Atomik orbitallerin birleştirilmesiyle bir dizi hibrit orbital üretilir. Bir kümedeki hibrit orbitallerin sayısı, seti üretmek için birleştirilen atomik orbitallerin sayısına eşittir.
- Bir dizi hibrit orbitaldeki tüm orbitaller şekil ve enerji bakımından eşdeğerdir.
- Bağlı bir atomda oluşan hibrit orbitallerin türü, VSEPR teorisi tarafından tahmin edildiği gibi elektron çifti geometrisine bağlıdır.
- Hibrit orbitaller, σ bağlar oluşturmak için üst üste biner. Hibritlenmemiş orbitaller, π bağlar oluşturmak için üst üste biner.
Aşağıdaki bölümlerde, yaygın hibrit orbital türlerine bakacağız
sp Hibridizasyon
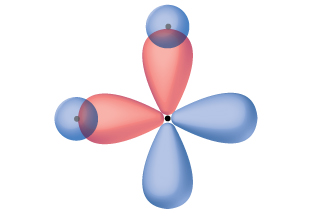
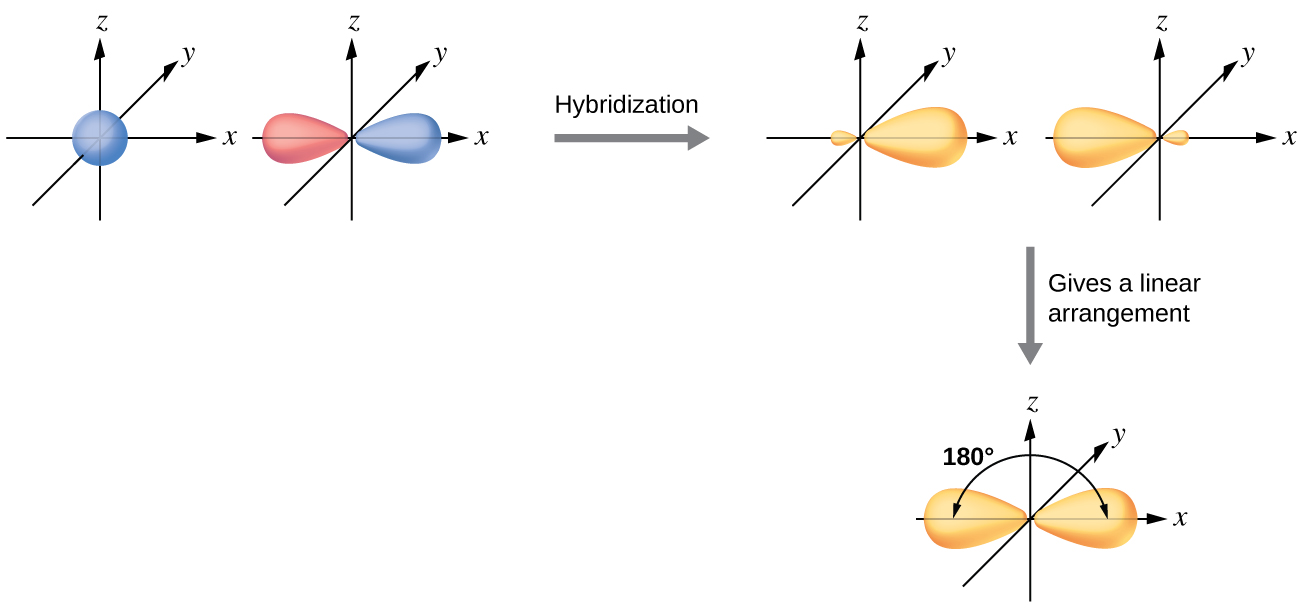
Gaz halindeki bir BeCl2 içindeki berilyum atomu Molekül, üç atomdan oluşan doğrusal bir düzenlemede yalnız bir elektron çifti olmayan merkezi bir atom örneğidir. BeCl2'de değerlik elektron yoğunluğunun iki bölgesi vardır iki kovalent Be-Cl bağına karşılık gelen molekül. Bu iki elektron alanını barındırmak için, Be atomunun dört değerlik orbitalinden ikisi, iki hibrit orbital verecek şekilde karışacaktır. Bu hibridizasyon işlemi, doğrusal bir geometride yönlendirilmiş iki eşdeğer sp hibrit orbitali elde etmek için değerlik s orbitalinin değerlik p orbitallerinden biri ile karıştırılmasını içerir ( Şekil 3 ). Bu şekilde, sp orbitalleri seti, orijinal p orbitaline şekil olarak benzer görünmektedir, ancak önemli bir fark vardır. Birleştirilen atomik orbitallerin sayısı her zaman oluşan hibrit orbitallerin sayısına eşittir. P orbitali, iki elektrona kadar tutabilen bir orbitaldir. sp kümesi, birbirinden 180°'yi gösteren iki eşdeğer orbitaldir. Başlangıçta s orbitalinde bulunan iki elektron, şimdi yarı dolu olan iki sp orbitaline dağıtılmıştır. Gaz halindeki BeCl2'de, bu yarı dolu hibrit orbitaller, iki özdeş σ bağı oluşturmak için klor atomlarından gelen orbitallerle örtüşecektir.
Şekil 4'deki yörünge enerji seviyesi diyagramında izole edilmiş bir Be atomundaki ve bağlı Be atomundaki elektronik farkları gösteriyoruz. Bu diyagramlar, her yörüngeyi yatay bir çizgi ( enerjisini gösteren ) ve her elektronu bir okla temsil eder. Enerji, diyagramın üst kısmına doğru artar. Bir orbitaldeki bir elektronu belirtmek için bir yukarı ok ve zıt dönüşlü iki elektronu belirtmek için iki ok ( yukarı ve aşağı ) kullanırız.
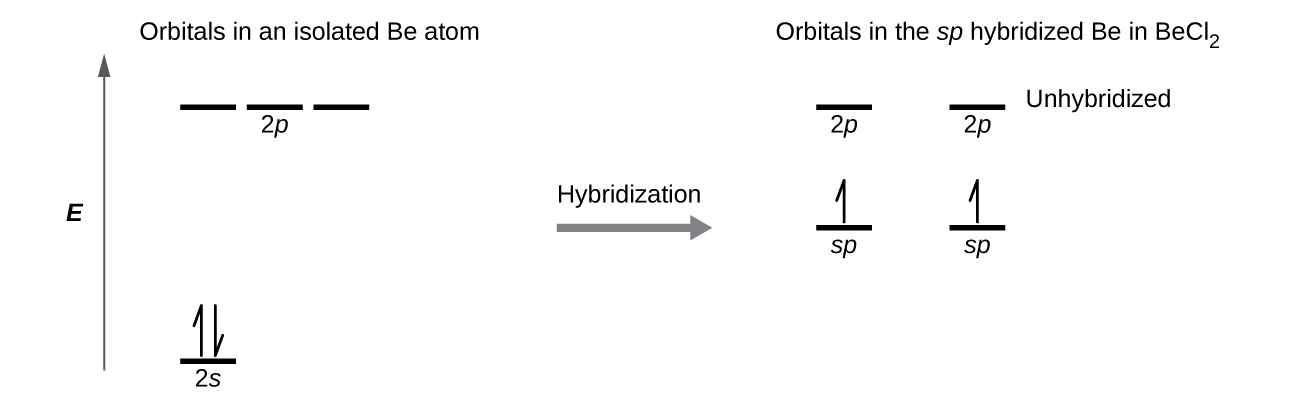
Atomik orbitaller melezleştiğinde, değerlik elektronları yeni oluşturulan orbitalleri işgal eder. Be atomunun iki değerlik elektronu vardı, bu nedenle sp orbitallerinin her biri bu elektronlardan birini alır. Bu elektronların her biri, Be-Cl bağlarının oluşumu sırasında bir hibrit orbital ve bir klor orbitali örtüştüğünde, bir klor atomu üzerindeki eşleşmemiş elektronla eşleşir.
Bir molekülde sadece iki değerlik elektron yoğunluğu bölgesi ile çevrili herhangi bir merkezi atom, sp hibridizasyonu. Diğer örnekler, doğrusal HgCl2'deki cıva atomunu içerir molekülü, Zn(CH3)2 içindeki çinko atomu, doğrusal bir C-Zn-C düzenlemesi ve HCCH ve CO2'daki karbon atomlarını içerir.
sp2 Hibridizasyon
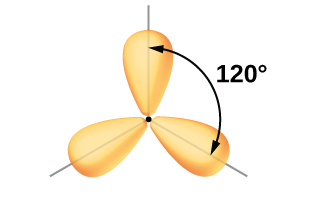
Elektron yoğunluğunun üç bölgesi ile çevrili merkezi bir atomun değerlik orbitalleri, üçlü bir kümeden oluşur sp2 Hibrit orbitaller ve bir hibritlenmemiş p orbitali. Bu düzenleme sp2'den kaynaklanmaktadır. Hibridizasyon, üçgen düzlemsel bir geometride yönlendirilmiş üç özdeş hibrit orbital üretmek için bir s orbitali ve iki p orbitalinin karıştırılması ( Şekil 5 ).
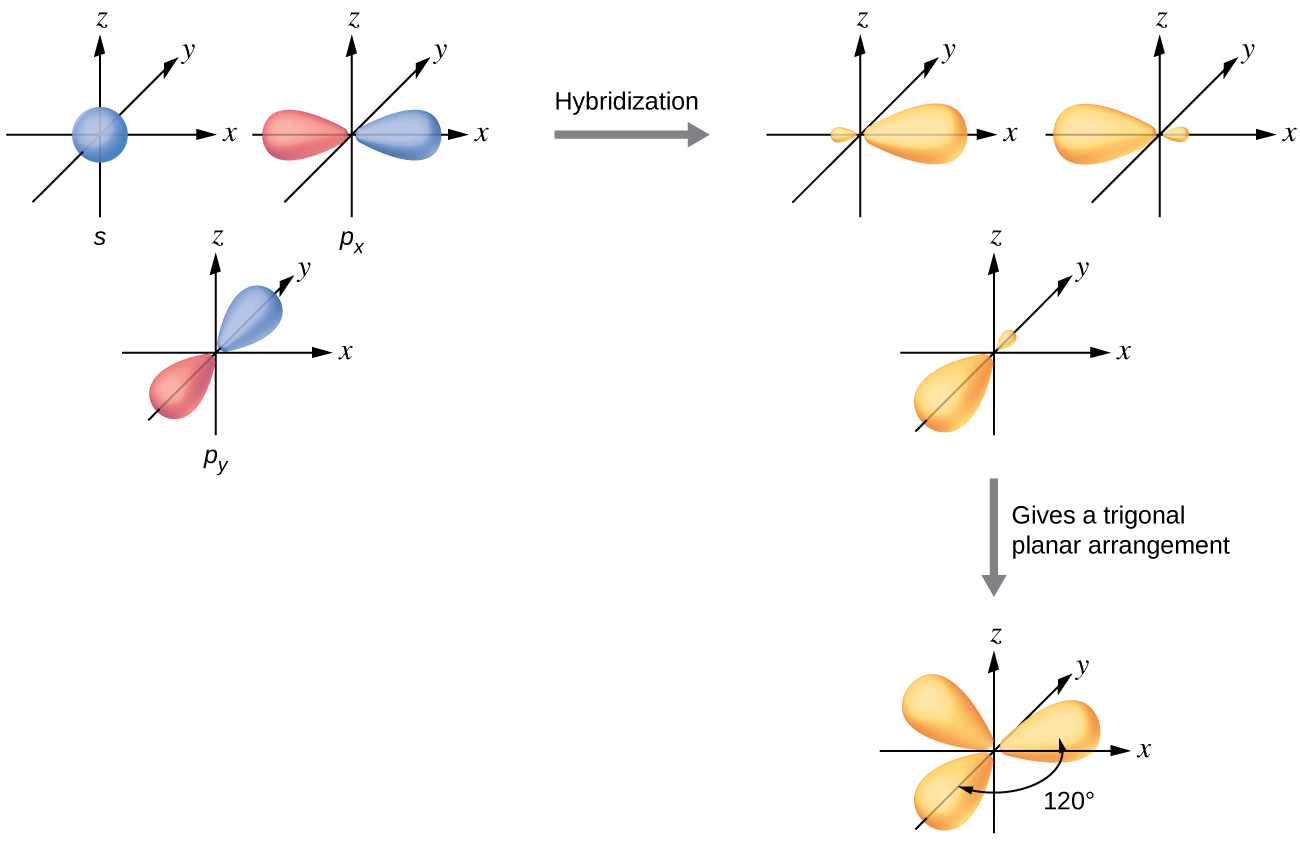
Kuantum mekaniği, Şekil 5'de gösterildiği gibi "dolgun" orbital lobları verse de, bazen netlik için bu orbitaller, belirli bir çizimin diğer özelliklerini gizlemekten kaçınmak için Şekil 6'daki gibi daha ince ve küçük loblar olmadan çizilir. Bu "daha ince" temsilleri, gerçek görünüm kolayca görselleştirilemeyecek kadar kalabalık olduğunda kullanacağız.
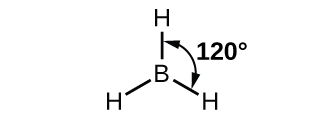
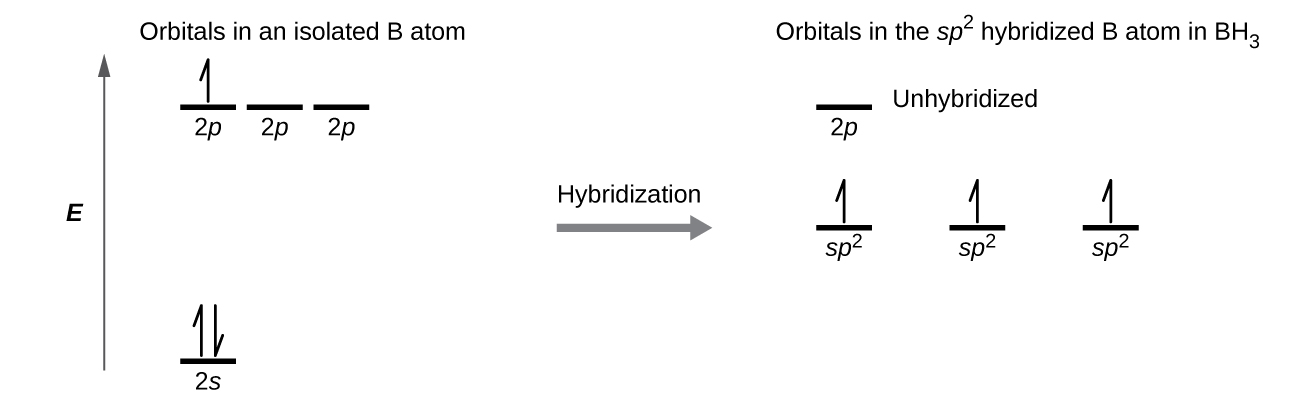
Boran molekülünün gözlenen yapısı, BH3, sp2'yi önerir Bu bileşikte bor için hibridizasyon. Molekül üçgen düzlemseldir ve bor atomu hidrojen atomlarına üç bağ halinde yer alır ( Şekil 7 ). İzole edilmiş bir bor atomundaki ve BH3'deki bağlı atomdaki orbitallerin ve elektron dağılımının karşılaştırmasını gösterebiliriz Şekil 8'teki yörünge enerji seviyesi diyagramında gösterildiği gibi. Bor atomunun üç değerlik elektronunu üç sp2'de yeniden dağıtıyoruz. hibrit orbitaller ve her bor elektronu, BH bağları oluştuğunda bir hidrojen elektronu ile eşleşir.
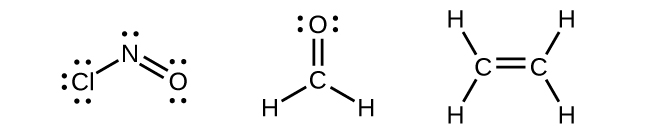
Elektron yoğunluğunun üç bölgesi ile çevrili herhangi bir merkezi atom sp2 gösterecektir Hibridizasyon. Bu, ClNO ( Şekil 9 ) gibi merkezi atom üzerinde yalnız bir çifte sahip molekülleri veya formaldehit, CH2O'de olduğu gibi merkezi atoma bağlı iki tek bağ ve bir çift bağa sahip molekülleri içerir ve ethene, H2CCH2.
sp3 Hibridizasyon
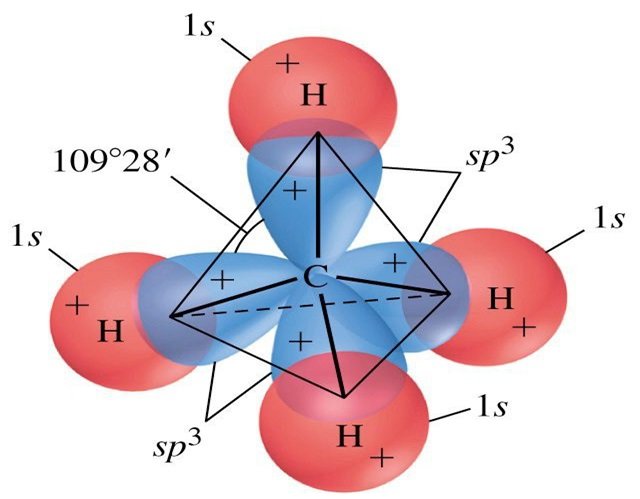
Bağ çiftleri ve yalnız çiftlerden oluşan tetrahedral bir düzenleme ile çevrili bir atomun değerlik orbitalleri, dörtlü bir kümeden oluşur sp3 Hibrit orbitaller. Melezler, bir s orbitalinin ve dört özdeş sp3 üreten p orbitalinin karıştırılmasından kaynaklanır hibrit orbitaller ( Şekil 10 ). Bu hibrit orbitallerin her biri, bir tetrahedronun farklı bir köşesine işaret eder.
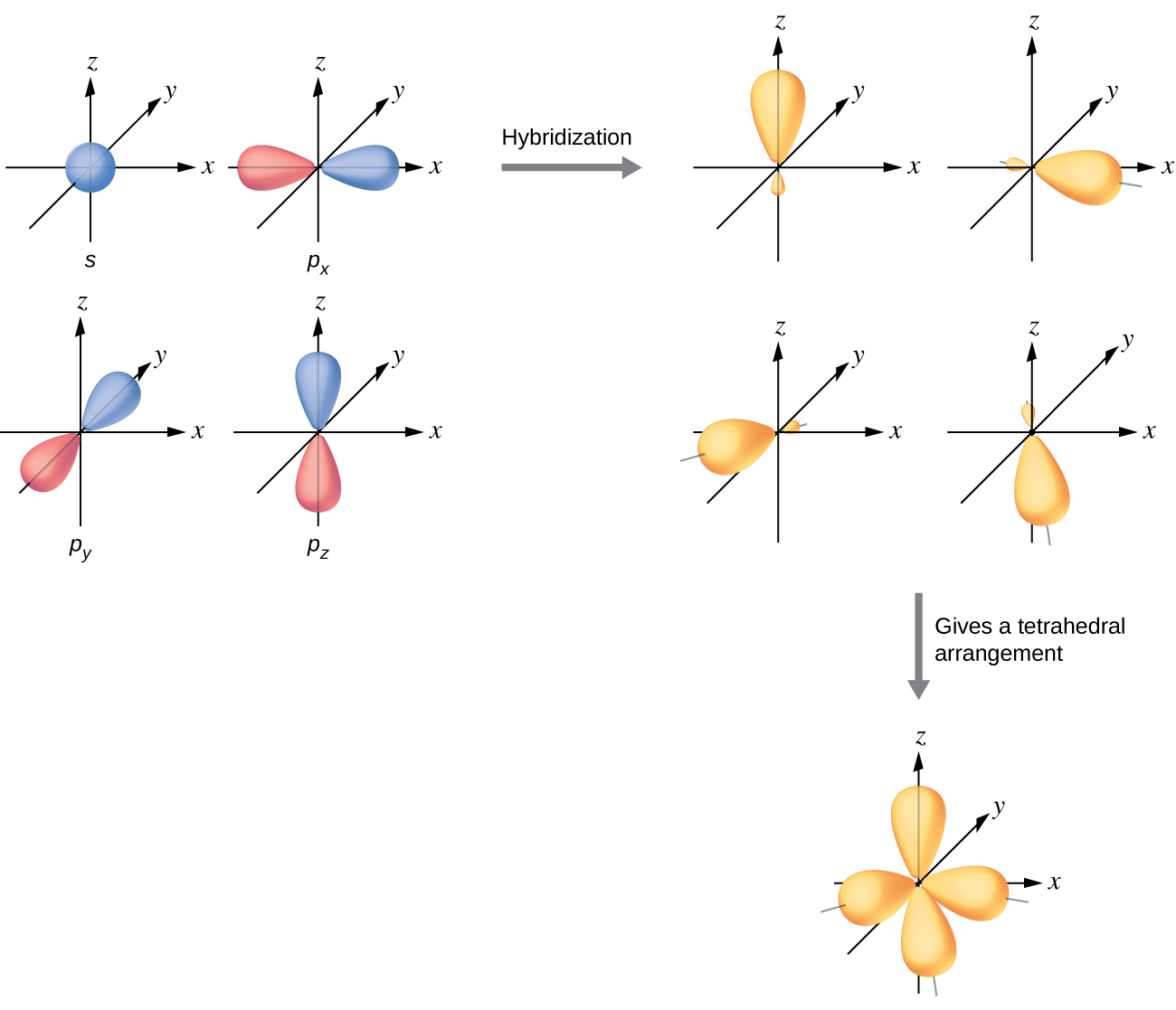
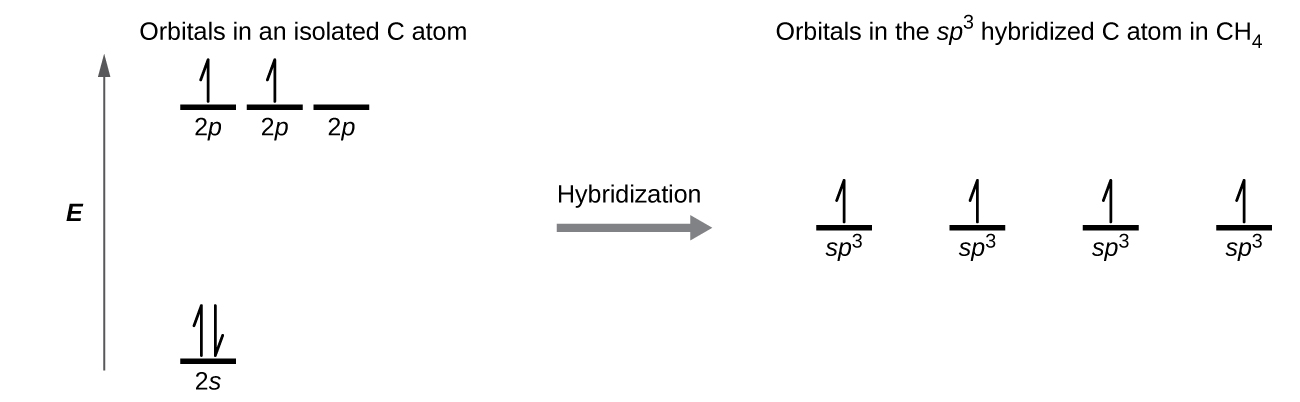
Bir metan molekülü, CH4, bir tetrahedronun köşelerinde dört hidrojen atomu ile çevrili bir karbon atomundan oluşur. Metandaki karbon atomu sp3 sergiler Hibridizasyon. İzole edilmiş bir karbon atomundaki ve CH4'deki bağlı atomdaki orbitalleri ve elektron dağılımını gösteriyoruz Şekil 11'de. Karbon atomunun dört değerlik elektronu, hibrit orbitallerde eşit olarak dağıtılır ve her karbon elektronu, C-H bağları oluştuğunda bir hidrojen elektronu ile eşleşir.
Bir metan molekülünde, dört hidrojen atomunun her birinin 1s orbitali, dört sp3'den biri ile örtüşür. bir sigma ( σ ) bağı oluşturmak için karbon atomunun orbitalleri. Bu, metan molekülü CH4'yi üretmek için karbon atomu ile hidrojen atomlarının her biri arasında dört güçlü, eşdeğer kovalent bağın oluşmasıyla sonuçlanır.
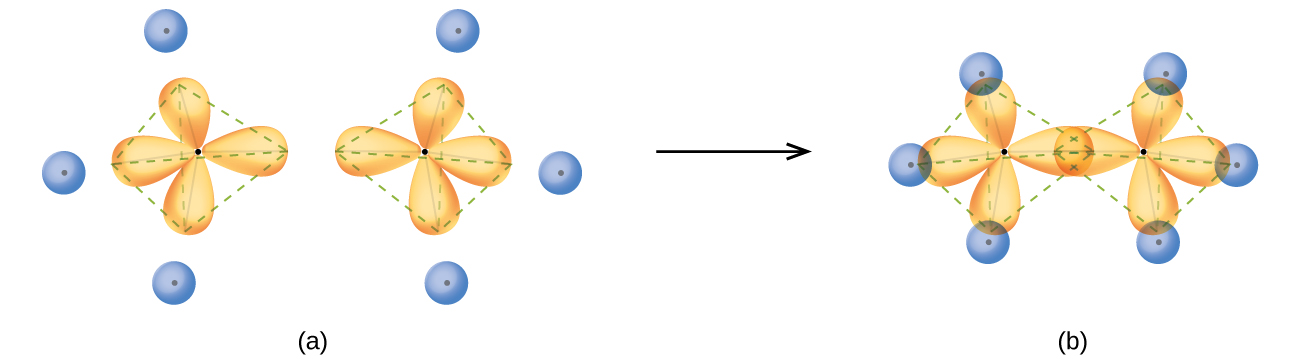
Etanın yapısı, C2H6, etan içindeki her karbonun, bir tetrahedronun köşelerinde düzenlenmiş dört komşu atoma sahip olması bakımından metanınkine benzer - üç hidrojen atomu ve bir karbon atomu ( Şekil 12 ). Bununla birlikte, etan içinde bir sp3 Bir karbon atomunun yörüngesi bir sp3 ile uçtan uca örtüşür iki karbon atomu arasında σ bir bağ oluşturmak için ikinci bir karbon atomunun yörüngesi. Kalan sp3'ün her biri Hibrit orbitaller, karbon-hidrojen σ bağları oluşturmak için bir hidrojen atomunun s orbitali ile örtüşür. Etanın bağlanma orbitallerinin yapısı ve genel taslağı Şekil 12'de gösterilmiştir. İki CH3'nin yönü Gruplar birbirine göre sabit değildir. Deneysel kanıtlar, σ bağları etrafında dönmenin kolayca gerçekleştiğini göstermektedir.
Bir sp3 Hibrit orbital ayrıca yalnız bir çift elektron tutabilir. Örneğin, amonyaktaki nitrojen atomu, üç bağ çifti ve bir tetrahedronun dört köşesine yönlendirilmiş yalnız bir elektron çifti ile çevrilidir. Azot atomu sp3'dür yalnız çift tarafından işgal edilen bir hibrit orbital ile melezlenmiştir.
Suyun moleküler yapısı, iki yalnız çift ve iki bağ elektron çiftinden oluşan tetrahedral bir düzenleme ile tutarlıdır. Böylece oksijen atomunun sp3 olduğunu söylüyoruz. hibritleşmiş, hibrit orbitallerin ikisi yalnız çiftler ve ikisi bağ çiftleri tarafından işgal edilmiştir. Yalnız çiftler, bağ çiftlerinden daha fazla yer kapladığından, yalnız çiftler içeren yapılar, idealden biraz bozulmuş bağ açılarına sahiptir. Mükemmel tetrahedra 109.5°'lik açılara sahiptir, ancak amonyak ( 107.3° ) ve suda ( 104.5° ) gözlenen açılar biraz daha küçüktür. Diğer sp3 örnekleri hibridizasyon CCl4'yi PCl3 ve NCl3 içerir.
sp3d ve sp3d2 Hibridizasyon
Üçgen bipiramidal bir düzenlemede beş bağ orbitalini tanımlamak için, değerlik kabuğu atomik orbitallerinden beşini ( s orbitali, üç p orbitali ve d orbitallerinden biri ) kullanmalıyız, bu da beşini verir sp3d hibrit orbitaller. Altı hibrit orbitalden oluşan oktahedral bir düzenlemeyle, altı değerlik kabuğu atomik orbitali ( s orbitali, üç p orbitali ve değerlik kabuğundaki d orbitallerinden ikisi ) kullanmalıyız, bu da altı verir sp3d2 Hibrit orbitaller. Bu hibridizasyonlar, yalnızca değerlik alt kabuklarında d orbitalleri olan atomlar için mümkündür ( yani, birinci veya ikinci periyottakiler için değil ).
Bir fosfor pentaklorür molekülünde, PCl5, bir trigonal bipiramidin köşelerine doğru yönlendirilmiş beş P-Cl bağı ( dolayısıyla fosfor atomu etrafında beş çift değerlik elektronu ) vardır. Beş sp3d setini oluşturmak için 3s orbitalini, 3p orbitalini ve 3d orbitallerinden birini kullanırız. P-Cl bağlarında yer alan hibrit orbitaller ( Şekil 13 ). sp3d sergileyen diğer atomlar hibridizasyon, SF4'deki kükürt atomunu içerir ve ClF3'deki klor atomları ve içinde ClF4+. ( Flor atomları üzerindeki elektronlar netlik için atlanmıştır. )
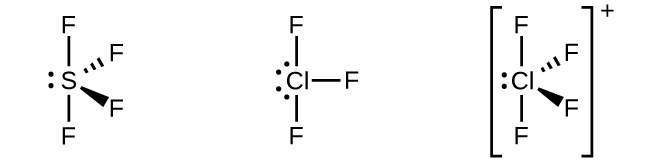
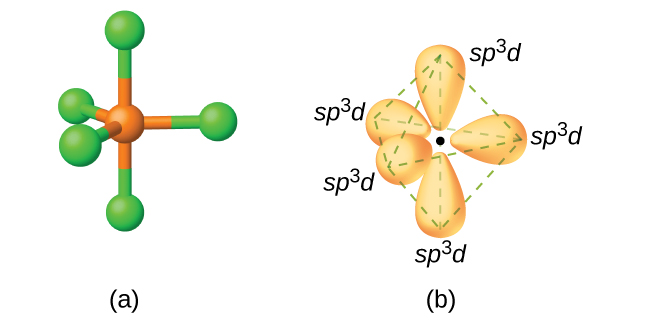
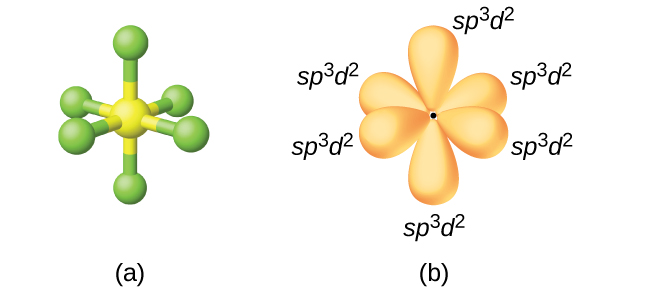
Kükürt heksaflorür içindeki kükürt atomu, SF6, sp3d2 sergiler Hibridizasyon. Bir kükürt heksaflorür molekülü, altı flor atomunu tek bir kükürt atomuna bağlayan altı bağ elektron çiftine sahiptir. Merkez atomda yalnız elektron çifti yoktur. Altı flor atomunu bağlamak için, 3s orbitali, üç 3p orbitali ve 3d orbitallerinden ikisi altı eşdeğer sp3d2 oluşturur her biri bir oktahedronun farklı bir köşesine yönlendirilmiş hibrit orbitaller. sp3d2 sergileyen diğer atomlar hibridizasyon, içindeki fosfor atomunu içerir. PCl6−, interhalojenlerdeki iyot atomu IF6+,IF5, ICl4−,IF4− ve XeF4'deki ksenon atomu.
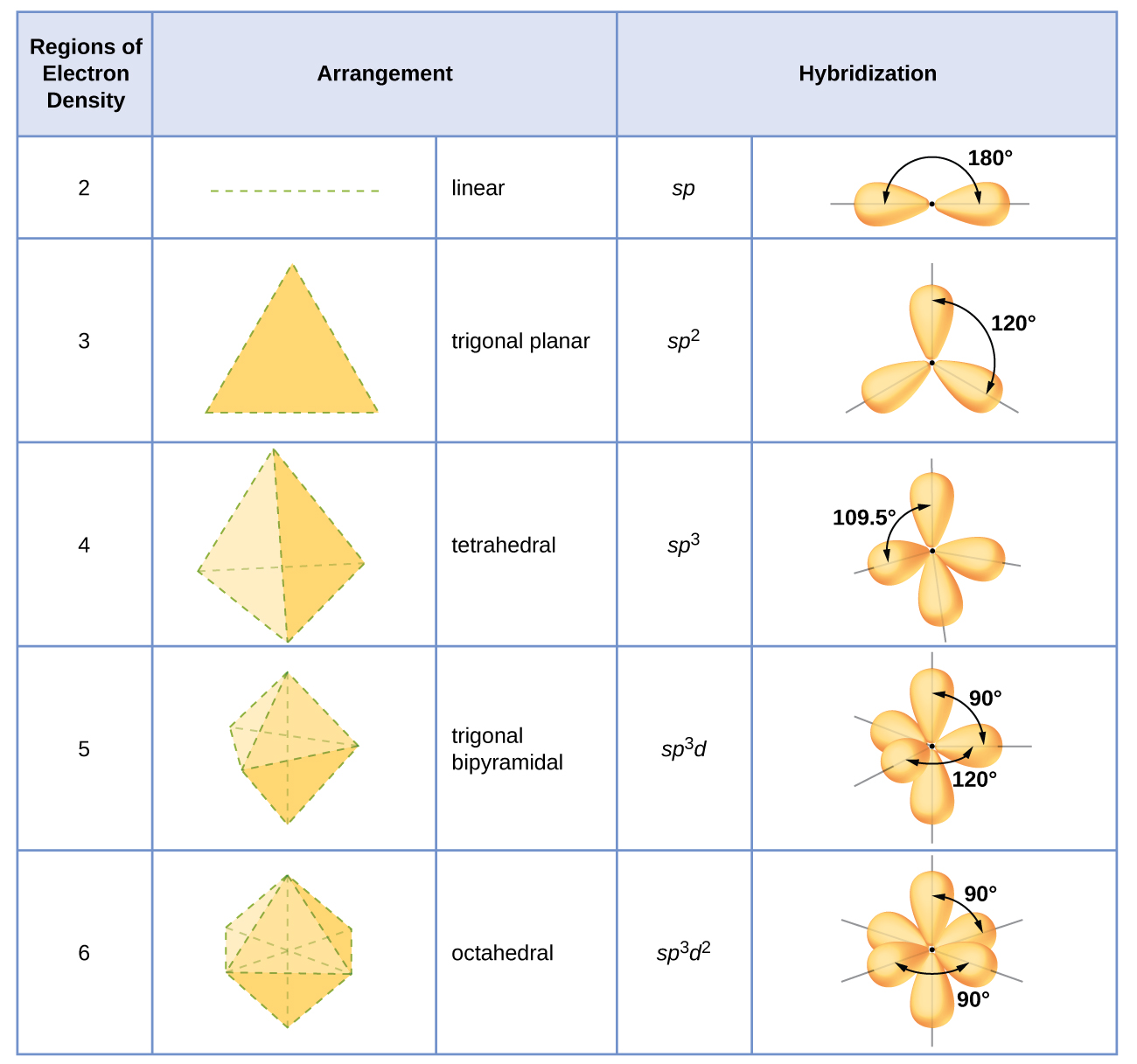
Hibrit Orbitallerin Merkez Atomlara Atanması
Bir atomun hibridizasyonu, onu çevreleyen elektron yoğunluğu bölgelerinin sayısına göre belirlenir. Çeşitli hibrit orbital kümelerinin karakteristik geometrik düzenlemeleri Şekil 16'da gösterilmiştir. Bu düzenlemeler, VSEPR teorisi tarafından tahmin edilen elektron çifti geometrilerininkilerle aynıdır. VSEPR teorisi, moleküllerin şekillerini tahmin eder ve hibrit orbital teorisi, bu şekillerin nasıl oluştuğuna dair bir açıklama sağlar. Merkezi bir atomun hibridizasyonunu bulmak için aşağıdaki yönergeleri kullanabiliriz:
- Molekülün Lewis yapısını belirleyin.
- Tek bağların, çoklu bağların, radikallerin ve yalnız çiftlerin her birinin bir bölge olarak sayıldığı VSEPR teorisini kullanarak bir atom etrafındaki elektron yoğunluğu bölgelerinin sayısını belirleyin.
- Şekil 16'dan bu geometriye karşılık gelen hibritleştirilmiş orbitaller kümesini atayın.
Hibridizasyonun, deneysel olarak gözlemlenen moleküler geometrileri rasyonelleştirmek için tasarlandığını hatırlamak önemlidir.
Model, değerlik elektron çiftlerinin uzayda birbirine yakın olduğu küçük merkezi atomlar içeren moleküller için iyi çalışır. Bununla birlikte, daha büyük merkezi atomlar için, değerlik-kabuk elektron çiftleri çekirdekten daha uzaktır ve daha az itme vardır. Bileşikleri, genellikle VSEPR teorisi ile tutarlı olmayan yapılar sergiler ve gözlemlenen verileri açıklamak için hibritleştirilmiş orbitaller gerekli değildir.
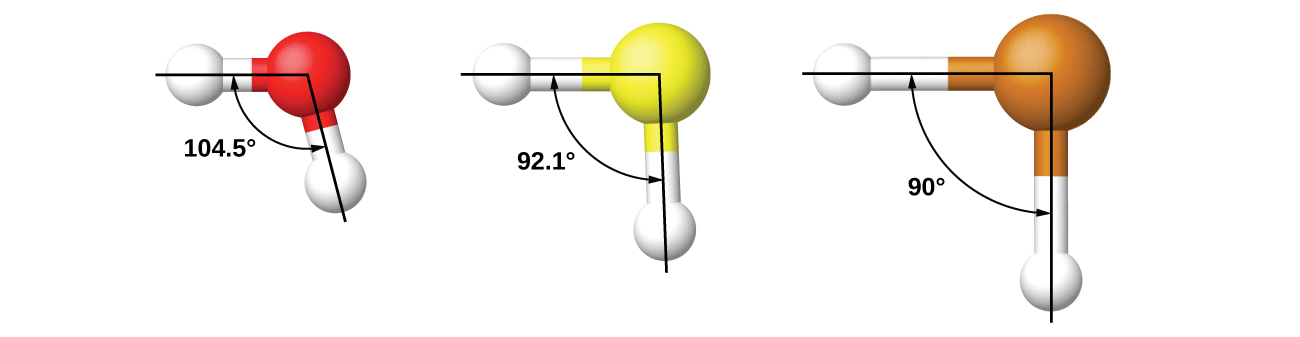
Örneğin, H2O'deki H–O–H bağ açısını tartıştık. 104.5°, sp3 ile daha tutarlı olan hibrit orbitaller ( 109.5° ) merkez atomda 2p orbitalinden ( 90° ) daha fazla. Kükürt, oksijen ile aynı gruptadır ve H2S benzer bir Lewis yapısına sahiptir. Bununla birlikte, kükürt üzerinde oksijenden çok daha az hibridizasyonun olduğunu gösteren çok daha küçük bir bağ açısına ( 92.1° ) sahiptir. Gruptan aşağı doğru devam edersek, tellür kükürtten bile daha büyüktür ve H için2Te, gözlemlenen bağ açısı ( 90° ), hibridizasyonun çağrılması olmadan 5p orbitallerinin örtüşmesi ile tutarlıdır. Gözlemlenen yapıları açıklamanın gerekli olduğu yerlerde hibridizasyonun çağrıştırıcılığını yapıyoruz.