Elektroliz Nedir, Nasıl Yapılır, Uygulama Alanları Nerelerdir?
Elektroliz terimi ilk olarak 19. yüzyılda Michael Faraday tarafından popüler hale getirildi. Saf elementlerin elde edilmesinde kimyasal reaksiyonların incelenmesine yardımcı olan bir süreçtir. Günümüzde elektroliz, cevherler gibi doğal olarak oluşan kaynaklardan saf elementlerin ayrılmasında veya elde edilmesinde yaygın olarak kullanıldığı için ticari olarak önemlidir.
Elektroliz Nedir?
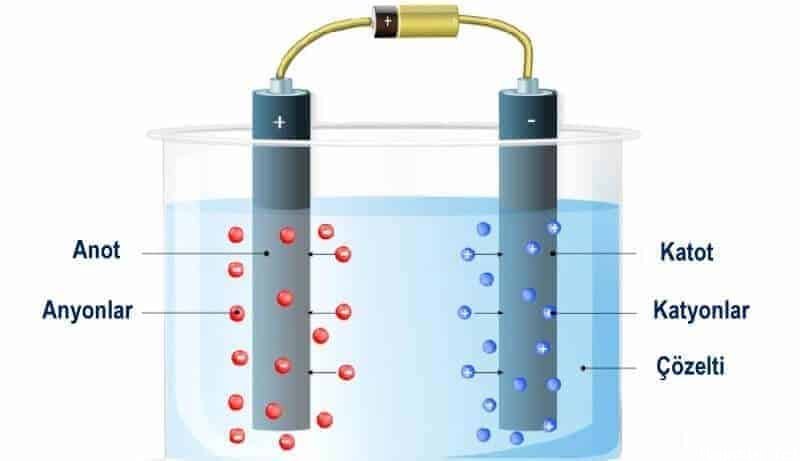
Elektroliz, iyonik bileşiklerin, sıvı bir formda bileşikten doğrudan bir elektrik akımı geçirilerek elementlerine ayrıştırılması işlemi olarak tanımlanır. Katyonlar katotta indirgenir ve anyonlar anotta oksitlenir. Elektroliz yapmak için gerekli olan ana bileşenler bir elektrolit, elektrotlardır ve bir tür harici güç kaynağına da ihtiyaç vardır. Ek olarak, iyon değişim membranı veya tuz köprüsü gibi bir bölme de kullanılır, ancak bu isteğe bağlıdır. Esas olarak ürünlerin karşı elektrotun yakınında yayılmasını önlemek için kullanılırlar.
Asitlenmiş veya tuz içeren bir su, orijinal elementlerine, hidrojen ve oksijene bir elektrik akımı geçirilerek ayrıştırılabilir. Erimiş sodyum klorür, sodyum ve klor atomlarına ayrıştırılabilir.
Elektroliz genellikle 'elektrolitik hücre' adı verilen, doğru akım kaynağına bağlı iki elektrot ( katot ve anot ) ve ayrışmaya uğrayan iyonik bir bileşik olan bir elektrolit içeren, erimiş halde veya uygun bir çözücü içinde çözünmüş halde yapılır. Genellikle metal, grafit ve yarı iletken malzemelerden yapılmış elektrotlar kullanılır. Bununla birlikte, uygun bir elektrot seçimi, elektrot ve elektrolit arasındaki kimyasal reaktiviteye ve üretim maliyetine göre yapılır.
Elektrolitik Proses
Elektroliz sürecinde, elektronların harici devreden eklenmesi veya çıkarılması nedeniyle iyon ve atom değişimi vardır. Temel olarak, geçen akımda katyonlar katoda hareket eder, katottan elektronları alır ( besleme kaynağı pili tarafından verilir ) ve nötr atoma boşaltılır. Nötr atom, eğer katıysa, katot üzerinde biriktirilir ve gaz ise yukarı doğru hareket eder. Bu bir indirgeme işlemidir ve katotta katyon indirgenir.
Aynı zamanda, anyonlar ekstra elektronlarını anoda bırakır ve anottaki nötr atomlara oksitlenir. Anyonlar tarafından salınan elektronlar elektrik devresi boyunca hareket eder ve devreyi tamamlayan katoda ulaşır. Elektroliz, anotta eşzamanlı bir oksidasyon reaksiyonu ve katotta bir indirgeme reaksiyonu içerir.
Örneğin, erimiş sodyum klorürden bir elektrik akımı geçtiğinde, sodyum iyonu katot tarafından çekilir, buradan bir elektrot alır ve bir sodyum atomu haline gelir.
Klorür iyonu anoda ulaşır, elektronunu verir ve klor molekülleri oluşturmak için klor atomları haline gelir.
Na(elektrolit içinde) + e+–(katottan) → Na .... Katot'ta
Cl–(elektrolitten) → e– + Cl → Cl2 …. Anot'ta
Elektroliz işlemi, doğrudan bileşiklerden temel formlar elde etmek için yararlı olmakla birlikte, alkali ve toprak alkali metallerin metalurjisinde, metallerin saflaştırılmasında, metallerin biriktirilmesinde, bileşiklerin hazırlanmasında vb. dolaylı olarak da kullanılabilir.
Hücre Potansiyeli veya Gerilimi
Elektroliz işlemi için gereken minimum potansiyel, tek tek iyonların elektronları emme veya serbest bırakma yeteneğine bağlıdır. Bazen elektrolizin gerçekleşmesini sağlayan bir elektrolitik hücrenin anot ve katodu arasındaki minimum voltaj ( elektrot potansiyelindeki fark ) olan ayrışma potansiyeli veya ayrışma voltajı olarak da tanımlanır.
Elektrolizin termodinamik olarak tercih edildiği voltaj, Nernst denklemi kullanılarak hesaplandığı gibi elektrot potansiyellerinin farkıdır. Aşırı potansiyel olarak adlandırılan ek voltaj uygulamak, reaksiyon hızını artırabilir ve genellikle termodinamik değerin üzerinde ihtiyaç duyulur. Özellikle oksijen, hidrojen veya klor gibi gazları içeren elektroliz reaksiyonları için gereklidir.
Bu yetenek, elektrolitik hücrede bulunan iyonların elektrot potansiyeli olarak ölçülür. Hücre potansiyeli, indirgeme ve oksidasyon reaksiyonu için gerekli potansiyelin toplamıdır. Çeşitli redoks reaksiyonlarında yer alan potansiyel, literatürde standart indirgeme potansiyeli olarak mevcuttur.
Pozitif redoks hücre potansiyelleri ile reaksiyon sadece termodinamik Gibbs serbest enerjisine ( veya standart potansiyele ) göre mümkün olacaktır. Genel olarak, elektroliz termodinamik olarak kontrol edilir.
Elektrolizde, buna eşit veya biraz daha fazla bir potansiyel harici olarak uygulanır. Kararlı olan ve reaksiyona girmeyen iyonlar, dışarıdan uygulanan potansiyel varlığında reaksiyona girer. Bu nedenle dış potansiyel, olumsuz bir tepkinin gerçekleşmesine neden olur. Elektrolizde, atomları birbirine bağlayan kimyasal bağlar ya yapılır ya da kırılır; Bu nedenle elektroliz, elektrik enerjisinin kimyasal enerjiye dönüştürülmesini içerir.
Faraday'ın Elektroliz Yasası
Redoks reaksiyonunun miktarı, hücreden akan elektrik miktarına bağlıdır. Reaksiyon miktarı veya boşaltılan iyon sayısı Faraday'ın elektroliz yasası ile verilir. İki yasa vardır: Faraday'ın birinci yasası ve ikinci yasası.
Faraday'ın birinci yasası şu şekilde özetlenebilir:
m = EQ/96485 = EIt/96485
Burada 'm', değişime uğrayan maddenin kütlesidir, 'E' maddenin eşdeğer kütlesidir, 'I' akımdır ve 't', akımın geçmesinin saniye cinsinden süresidir.
Faraday'ın ikinci yasası, aynı akım için değişime uğrayan farklı maddelerin kütlesini karşılaştırır.
İkinci yasaya göre,
M1/M2 = E1/E2 veya M1/M2 = M1/E2
Burada M ve E, sırasıyla maddelerin değişen kütlesi ve eşdeğer kütlesidir.
Elektroliz Ürünü
Elektroliz reaksiyonlarının ürünleri, elektrolitik hücrede bulunan oksitleyici ve indirgeyici türlere bağlıdır. Elektroliz, bileşikte bulunan ürünleri üretecektir. Birden fazla katyon ve anyon mevcut olduğunda, her iyon indirgeme ve oksidasyon için rekabet edecektir. Daha pozitif redoks potansiyeline sahip reaksiyonlar, diğerlerine göre azaltılacak veya oksitlenecektir.
Bu nedenle, mevcut birden fazla redoks çiftine rağmen, yalnızca biri indirgenebilir veya oksitlenebilir. Bazen, indirgenen veya oksitlenen iyonlar nispi miktarlarına bağlı olabilir. Başka bir deyişle, redoks reaksiyonu ve elektroliz kinetik olarak kontrol edilebilir. Bu gibi durumlarda, analiz ürünü, elektrolitte bulunan çeşitli iyonların nispi konsantrasyonuna göre farklılık gösterebilir.
Örneğin, sulu sodyum klorürün elektrolizi farklı ürünler verebilir:
- Hidrojen ve klor
- Hidrojen ve oksijen
- Hidrojen, oksijen ve klor.
Elektrolizi Etkileyen Faktörler
Elektrolizi etkileyebilecek faktörler aşağıda listelenmiştir:
i) Elektrotun niteliği
ii) Elektrolitin doğası ve durumu
iii) Elektrolitte bulunan iyonların doğası ve elektrot potansiyeli
iv) Elektrotlarda aşırı gerilim.
i ) Elektrolitin Doğası ve Durumu
Elektroliz, iyonların zıt yüklü elektrotlara doğru hareketini içerir. Doğal olarak, elektrolit hareketli iyonlara sahip olmalıdır. Katılarda iyonlar belirli konumlardadır ve normal sıcaklıklarda hareket edemezler. Bu nedenle, katılar elektroliz için uygun değildir.
Elektroliz için elektrolitler sıvı formda olmalıdır – erimiş veya uygun bir polar çözücü ile çözelti içinde. Sodyum klorür, erimiş halde veya sulu bir çözelti içinde elektrolize uğrayacaktır.
ii ) Elektrolitte Bulunan İyonların Doğası ve Elektrot Potansiyeli
- İki elementel iyonun elektrolitlerinin elektrolizi basittir ve elektrolizde iki element verir. Erimiş sodyum klorür, sodyum atomları ve klor molekülleri verir.
- Radikal iyonların elektrolizi, element atomlarını vermez.
- Birden fazla iyonik bileşik içeren elektrolitler, bağıl redoks potansiyellerine bağlıdır.
- Elektrolitlerin sulu çözeltilerinin elektrolizi – Su molekülleri ayrıca redoks reaksiyonlarına girebilir ve elektrolit iyonlarının redoks reaksiyonlarıyla rekabet eder.
- Erimiş sodyum klorürün elektrolizi, sodyum ve klor verir. Ancak, sulu sodyum klorürün elektrolizi, sodyum değil hidrojen ve klor verir.
iii ) Elektrotun Niteliği
Aynı elektrolit için, elektrolitin doğası farklı ürünler verebilir. Sulu bakır sülfat çözeltisi elektrolize edildiğinde, aşağıdaki redoks reaksiyonları mümkündür.
Katotta: pH'da indirgeme =7
Cu2+(aq) + 2e– →Cu (s) E° = 0.34V ve 2H2O + 2e–→ H2 + 2OH– E° = -1.02V
Anotta: pH = 7'de oksidasyon
Cu(s) →Cu2+(aq) + 2e– E° = – 0.34V ve 2H2O → O2(g) + 4H + 4e+– E° = +1.4 V
Katotta, iki elektrottan bakır iyonlarının indirgeme potansiyeli, suyun indirgenmesinden daha pozitiftir. Bu nedenle, elektrottan bağımsız olarak, elektrolitten gelen bakır iyonları azaltılacak ve katot üzerinde birikerek kütlesini artıracaktır. Ancak anottaki reaksiyon elektroda bağlıdır.
Platin, grafit vb. inert elektrotlarla elektroliz – İnert elektrotlar elektrolit veya ürünlerle reaksiyona girmez, bu nedenle herhangi bir değişikliğe uğramaz. Suyun oksidasyonu daha pozitif potansiyele sahip olduğundan, anotta oksijen gelişecektir.
Ancak bakır anot olarak kullanılırsa, elektrolit konsantrasyonunu korumak için sülfat iyonu ile reaksiyona girer. Yani herhangi bir gaz evrimi olmayacak; Bunun yerine, anot kütlesi yavaşça azalır ve çözeltiye girer.
iv ) Elektrotlarda aşırı gerilim
Elektrolit iyonlarının redoks potansiyeli, elektroliz reaksiyonlarına ve ürünlerine karar verir. Bazen, elektroliz sırasındaki bazı yarı reaksiyonların redoks potansiyelleri, termodinamik potansiyellerden daha fazladır. Yarı reaksiyonun bu aşırı voltajı ( aşırı voltaj ) reaksiyonu elverişsiz hale getirebilir ve elektroliz ürününü değiştirebilir.
Anottaki sulu sodyum klorürün hidrolizinde iki oksidasyon reaksiyonu meydana gelebilir. Su ve klorürün indirgeme potansiyeli sırasıyla +0.82V ve 0.1.36V'dir.
2H2O→O2(g) + 4H + 4e+–+ E° = -0,82 V
2Cl– → Cl2 + 2e– E = – 1.36V
Suyun oksidasyonunun daha pozitif olması daha mümkündür, bu nedenle oksijen gazının oluşumu anotta gerçekleşmelidir. Ancak, oksijenin sudan evrimi -0.6V'luk bir aşırı gerilime sahiptir, bu da suyun oksidasyonu için voltajı -1.42V yapar. Klorür oksidasyonu, su oksidasyonunun net voltajından daha pozitiftir. Klorür anotta klora oksitlenir. Klor, aşırı gerilim nedeniyle oksijen değil serbest bırakılır.
Elektroliz Uygulamaları
Elektroliz, yukarıda belirtildiği gibi, sıvı haldeki bir bileşiğin iyonlarını, bileşikten bir elektrik akımı geçirerek indirgenmiş veya oksitlenmiş hallerine dönüştürme işlemidir. Böylece elektroliz, hem deneysel hem de endüstriyel ürünlerde birçok uygulama bulur. Önemli olanlardan bazıları aşağıda verilmiştir:
1) Maddelerin eşdeğer ağırlıklarının belirlenmesi.
2) Alkali ve toprak alkali metallerin metalurjisi.
3) Metallerin saflaştırılması.
4) Saf gazların imalatı.
5) Sodyum hidroksit, sodyum karbonat, potasyum klorat vb. bileşiklerin imalatı.
6) Korozyon direnci, süs eşyaları vb. İçin galvanik kaplama.
Elektrolizin farklı uygulamalarını aşağıda ayrıntılı olarak tartışacağız.
Maddelerin Eşdeğer Ağırlıklarının Belirlenmesi
Faraday'ın ikinci yasasının, biriken maddelerin kütlesinin eşdeğer ağırlıklarıyla orantılı olduğunu belirttiğini biliyoruz. Biriken herhangi bir maddenin kütlesi matematiksel olarak şu şekilde ilişkilendirilebilir:
M1/E1 = M2/E2
Bilinmeyen bir metal veya maddenin eşdeğer kütlesi, çözeltilerden bilinen bir akım geçirilerek ve ilgili hücrelerinde biriken maddelerin kütlesi ( M1 ve M2 ) belirlenerek hesaplanabilir. Bir maddenin eşdeğer kütlesi biliniyorsa, bilinmeyen maddenin eşdeğer kütlesi yukarıdaki denklemden hesaplanabilir.
Erimiş tuzların elektrolizi
Alkali ve toprak alkali metalurjisi ve üçüncü grup metallerin metal cevherleri konsantre edilir ve çoğunlukla oksitlere dönüştürülür. Oksitler, karbon, alüminyum vb. indirgeyici maddelerle indirgenir. Alkali ve toprak alkali metaller en büyük indirgeme potansiyellerine sahip olduğundan, diğer metaller veya bileşikleri bunları azaltamaz.
Alkali ve toprak alkali metallerin izolasyonunun tek yolu, erimiş klorürlerini doğrudan elektrolize etmektir. Kalsiyum klorürler gibi diğer halojenürlerle karıştırmak, saf halojenürlerin erime noktasını azaltır.
Elektrorafinasyon – Metallerin Saflaştırılması
Cevherlerin konsantrasyonu ve indirgenmesinden sonra elde edilen metaller yaklaşık % 90 - 99 saflığa sahiptir. Anot olarak saf olmayan metal ve katot olarak saf metal ile metal tuzunun sulu bir çözeltisi elektrolize edilir. Katot üzerinde % 99'dan fazla saflıkta saf metal birikir ve safsızlıklar altta çamur olarak toplanır. Bakır ve nikel, elektrorafinasyon ile saflaştırılan metalin bazı örnekleridir.
Galvanik
Bir nesne, elektroliz yoluyla seçilen bir metal ile gerekli kalınlığa kadar kaplanabilir. Kaplanacak nesne katottan yapılır. Kaplanacak metal tuzunun sulu bir çözeltisi elektrolittir. Aynı metal veya herhangi bir inert metal anot olabilir. Elektrolizde, elektrolitten gelen metal iyonu nesne üzerinde biriktirilir. Çözeltideki metal iyonlarının kaybı, aynı metal anodu yaptıysa telafi edilecektir.
Biriktirme, metali süs eşyaları vb. yapmak için korozyondan korumak için kullanılabilir. Demirin çinko, kurşun, krom ve nikel gibi metallerle kaplanması, demirin korozyon direncini artırır. Süs eşyası yapımında daha ucuz metaller üzerine altın ve gümüş kaplama kullanılır.
Elektrokimyasal işlemede ( ECM ) de kullanılır. Burada, bir elektrolitik katot, bir iş parçasından anodik oksidasyon yoluyla malzemeyi çıkarmak için şekillendirilmiş bir alet olarak kullanılır. ECM tekniği genellikle çapak alma veya alet veya bıçak gibi metal yüzeylere kalıcı bir işaret veya logo koymak için kullanılır.
Elektro şekillendirme
Elektroformlama, elektroliz kullanarak nesnelerin bir kopyasını yapma işlemidir. Kopyalanacak nesne, bir kalıp yapmak için balmumu içinde preslenir. Grafit tozu, iletken hale getirmek için düzgün bir şekilde kaplanır. Bu bir katot olarak kullanılır ve biriktirilecek metalin tuzu elektrolit olarak alınır. Elektroliz ile gerekli kaplama elde edildikten sonra, balmumu ve grafit eritilir.
Saf Gaz İmalatı
Hidrolizdeki sulu tuzlar, nispi tuz ve su konsantrasyonlarına bağlı olarak farklı ürünler verir. Konsantre tuzlu suyun ( sodyum klorür ) elektrolizi, saf hidrojen ve klor gazları oluşturur. Saf klor gazı, Klor-alkali endüstrilerinde tuzlu su sulu çözeltisinin elektrolizi ile toplanır.
Saf hidrojen ve oksijen, alkali ve toprak alkali metallerin asit veya baz veya inert tuzu varlığında suyun hidrolizi ile elde edilir. Ticari kullanım için hidrojen yüzdesi, dünya çapında suyun elektrolizi ile üretilir.
Suyun sürekli elektrolizi, döteryum iyonlarını bırakarak tüm normal hidrojen izotoplarını uzaklaştırır. Normal suyun elektrolizinden sonra kalan döteryum oksit 'ağır su'dur. Nükleer reaksiyonlardan elektrik enerjisi üreten nükleer reaktörlerde moderatör olarak ağır su kullanılır.
Bileşiklerin imalatı
Sodyum hidroksit, sodyum hidrosülfit, potasyum permanganat, potasyum klorat, amonyum sülfat, ağır su vb. bileşikler elektroliz yoluyla üretilir. Sodyum hidroksit, kloralkali endüstrilerinde tuzlu suyun elektrolizi ile klor gazı hazırlayan bir yan üründür.
Potasyum permanganat, potasyum manganit çözeltisinin elektrolizi ile elde edilir. Elektroliz üzerine amonyum sülfat veya amonyum bisülfat, amonyum persülfat oluşturur.
Elektrokristalizasyon
Bu, özel bir elektroliz uygulamasıdır. Bu işlemde, iletken kristaller, in situ olarak üretilen oksitlenmiş veya indirgenmiş türlerden elde edilen elektrotlardan biri üzerinde büyütülür. Bu teknik, doğrusal zincir bileşikleri veya yük transfer tuzları gibi düşük boyutlu elektrik iletkenlerinin tek kristallerini üretmek için yaygın olarak kullanılır.
Elektroliz Soruları ve Çözümleri
1. 14 cm çapında ve 1 metre uzunluğunda bir demir boru, çinko nitrat çözeltisi ve 25 amperlik bir akım kullanılarak 0,01 cm kalınlığa kadar galvanizlenecektir. Çinko anottan kütle kaybı ne olacak ve elektroliz için gereken süre ne olacak? Çinkonun yoğunluğu 7.14 g / cm3'dür. Çinkonun eşdeğer ağırlığı 32.8'dir
Çinko kaplamanın hacmi = 2πrxl × 0,01 cm3
Kaplanacak çinkonun kütlesi= V × d
=2 × 22/7 × 14/2 × 1000 × 0.01
= 440g
Anottan kaybedilen çinko kütlesi = 440g.
Faraday'ın elektrolizin birinci yasasına göre,
m = EQ/96485 = EIt/96485 veya t = 96485xmExl = 96485x440/32.8x25
= 51772 saniye
= 14.4 saat
2. Bir saat boyunca az miktarda sodyum sülfat içeren nötr sudan 3 amperlik bir akım geçirilir. Bir atmosferde salınan hidrojen miktarını hesaplayın.
Geçilen coulomb sayısı = 3 × 60 × 60
Suyun hidrolizinin yarı reaksiyonları -
Katotta: 2H2O + 2e– → H2(g) + 2OH–
Anotta: 2H2O → O2(g) + 4H + 4e+–
Suyun elektrolizinin net reaksiyonu, 2H'dir. 2Ø → 2H2(g) + O2(g) şeklinde değiştirilmiştir.
Dört faraday veya 4 x 96485 coulomb elektrik akımı, 2 mol veya 2× 22.4L hidrojen gazı açığa çıkarır.
10800 coulomb elektrik akımı hidrojeni serbest bırakır
=2×22.4×10800/4×96485
= 1.25L
Su üzerindeki toplam basınç = su buharı basıncı + hidrojen basıncı
Hidrojenin basıncı = Su üzerindeki toplam basınç – su buharı basıncı
Hidrojen basıncı = 1atm – 0.0316atm =0.9684atm
Böylece, serbest bırakılan hidrojen hacmi
=1.25/0.968
= 1.29L
Elektroliz Hakkında Sıkça Sorulan Sorular
1. Elektroliz nedir?
Elektroliz, bir maddeden elektrik akımı geçtiğinde meydana gelen kimyasal bir reaksiyondur. Madde, kimyasal bir reaksiyon sırasında bir elektron alır veya kaybeder.
2. Elektrolitik hücre nedir?
Bir pozitif ve bir negatif elektrot ayrı tutulur ve bir elektrolitik hücrede pozitif ve negatif yüklü iyonlar içeren bir çözeltiye daldırılır.
3. Elektroliz işlemi nerede kullanılır?
Elektroliz işlemi, metal ekstraksiyonu ve diğer bileşiklerden saflaştırma ve elektrokaplama dahil olmak üzere metalurjik işlemlerde yaygın olarak kullanılmaktadır. Erimiş sodyum klorürün elektrolizi, metalik sodyum ve klor gazı üretir. Suyun elektrolizi hidrojen ve oksijen üretir.