Elektrik Enerjisi Kaynağı Olarak Kimyasal Enerji
Kimyasal reaksiyon, elektrik enerjisi üretmek için tasarlanmış ilk doğru ve kullanılabilir süreçti. Luigi Galvani süreci ilk keşfetti ve sonuçlarını 1792'de yayınladı. 1800 yılında Allesandro Volta, Galvani'nin bulgularına dayanarak ilk pil olan voltaik yığını inşa etti. Volta, bulgularını Londra Kraliyet Cemiyeti ile belgeledi. Bu hazır ve güvenilir elektrik enerjisi kaynağı, elektriğin doğasına yönelik araştırmaları teşvik etti.
Voltaik yığın, bir tuzlu su çözeltisine batırılmış gözenekli bir malzeme ile çinko disklerden ayrılmış bir dizi gümüş diskten oluşur. Her iki uca bir iletken bağlanır. Gümüş terminal pozitif elektrottur ve çinko terminal negatif elektrottur. Volta daha sonra bir kostik çözeltisinde bir bakır plaka ve bir çinko plaka kullanarak daha verimli bir kombinasyon geliştirdi. Şekil 1'e bakın.
Hücre, neredeyse sabit bir voltajda elektrik üreten bir cihazdır. Bir hücre, bir asit veya alkali çözelti içinde iki metalik elektrotun birleşiminden oluşur. Örneğin, bir kostik çözeltisindeki bakır ve çinko kimyasal bir hücredir. Pil, kimyasal enerjiyi elektrik enerjisine dönüştüren bir DC voltaj kaynağıdır. Tek bir hücrenin sağladığından daha yüksek bir potansiyel veya akım sağlamak için iki veya daha fazla hücre birleştirildiğinde bir pil oluşur. Voltaik yığın bir pildir. Not: Voltaik yığındaki hücreler seri olarak birleştirilir.
Hücreler seri olarak bağlandığında, voltajları birbirine eklenir. Seri olarak bağlanan hücreler aynı akıma sahip olacaktır, çünkü bir yüke akım iletme yeteneği en düşük hücrenin akım derecesi ile sınırlıdır. Hücreler paralel bağlandığında, akımları birbirine eklenir. Paralel bağlanan hücrelerin tümü aynı voltaj değerine sahip olmalıdır. Paralel kombinasyondaki pillerden biri diğerlerinden daha yüksek bir voltaja sahipse, çıkış voltajını diğer hücrenin nominal voltajına düşürmek için bir deşarj akımı akacaktır. Örneğin, üç adet 1,5 V/1,0 A hücre, seri bağlandığında 4,5 V/1,0 A ve paralel bağlandığında 1,5 V/3,0 A üretir. 4,5 V/3,0 A pil üretmek için dokuz adet 1,5 V/1,0 A hücrenin seri/paralel kombinasyonu kullanılabilir. Şekil 2'ye bakın.
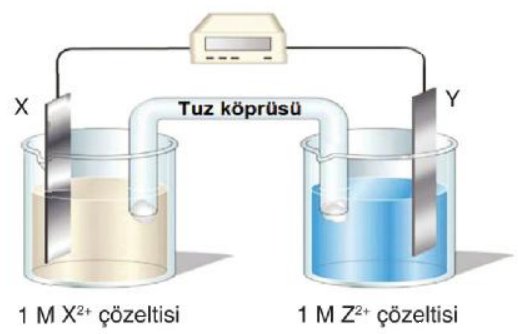
Birbirine benzemeyen metallerden oluşan iki elektrot bir elektrolite daldırıldığında kimyasal bir hücre oluşur. Elektrolit bir asit, alkali veya tuz çözeltisi olabilir. Elektrolitin amacı, kullanılabilir malzemeleri rafine etmek veya üretmektir.
Sülfürik asit gibi bir asit ( H2SO4 ), çözelti içinde su ( H2O ), kimyasal iyonlaşma meydana gelir. İyonizasyon, atomların ve moleküllerin elektrik yükü olan parçacıklara ayrılmasıdır. Bu yüklü parçacıklara iyon denir. Parçacıklar negatif ( elektron fazlalığı ) veya pozitif ( elektron eksikliği ) yüklü olabilir. Su ve sülfürik asit bir elektrolit olarak karıştırıldığında, sülfürik asit molekülleri üç iyona ayrılır: iki hidrojen iyonu ( H+ H+ ) ve bir sülfat iyonu ( SO42– ). Negatif ve pozitif yüklerin sayısı eşit olduğunda çözeltide iyonik bir denge kurulur. Şekil 3'e bakın.
Bir çinko ( Zn ) elektrot elektrolite daldırıldığında, sülfürik asit çinkonun bir kısmını çözelti içinde çözerek pozitif yüklü çinko iyonları ( Zn++ ) üretir. Oluşan her çinko iyonu için çinko elektrot üzerinde iki serbest elektron kalır. Zamanla, çinko elektrot negatif yüklü hale gelirken, elektrolit pozitif yüklü hale gelir. Bir denge kurulur. Pozitif çinko iyonları, negatif çinko elektrotun yakınında toplanır.
Bir bakır elektrot elektrolite daldırıldığında, pozitif hidrojen iyonları bakır elektrota çekilir ve burada bir elektron alarak yüklerini nötralize eder. Nötr hidrojen atomları, hidrojen gazı ( H ) atomları haline gelir. Hidrojen gazı bakır elektrotun etrafında toplanır ve çözeltinin tepesine yükselen kabarcıklar olarak görülebilir. Elektron kaybı nedeniyle, bakır elektrot pozitif yüklü hale gelir ve bir denge kurulur. Şekil 4'e bakın.
Artık bakır ve çinko elektrotlar arasında bir elektrik potansiyeli vardır. Potansiyelin miktarı kullanılan metale bağlıdır. Elektrotlar, bir metalin başka bir metale kıyasla elektron verme kolaylığına bağlı olarak kimyasal hücreler için seçilir. Bir çinko-bakır hücre için potansiyel yaklaşık 1.08 V'tur. Bu potansiyele ulaşıldığında, hücrenin elektrotlarına bir yük bağlanana kadar kimyasal etki durur.
Elektrotlara bir yük bağlandığında, elektronlar negatif çinko elektrottan yük boyunca ve pozitif bakır elektrota geçer. Bu, hücrenin kimyasal dengesini bozar. Çinko elektrotta artık elektron eksikliği vardır ve bakır elektrotta fazla elektron vardır. Bu değişikliği telafi etmek için, elektrolitteki pozitif hidrojen iyonları, aşırı elektronları kabul ettikleri ve nötralize edildikleri bakır elektrota akar. Nötr hidrojen iyonları bakır elektrotta yukarı doğru hareket eder ve çözeltiyi bir gaz olarak bırakır. Çinko elektrot üzerindeki negatif parçacıkların kaybı nedeniyle, negatif sülfat molekülleri çinko elektroda çekilir. Çinko atomları tekrar elektrolite girer. Bu, çinko elektrotun bazı negatif yükler biriktirmesine izin verir.
Çinko tüketilmediği sürece, yük akımı çektiği için terminaller üzerindeki yükler değiştirilir. Bu nedenle, potansiyel neredeyse sabit kalır.
Günlük Cihazlarımız Kimyasal Enerjiyi Elektriğe Dönüştürüyor
Bir hücre veya pil, elektrotlarına bir yük yerleştirildiğinde elektrik potansiyelini kimyasal olarak depolar ve serbest bırakır. 1830'larda, telgraf sistemleri pillerin önemli bir tüketicisi haline geldi ve üretimlerini karlı bir ticari girişim haline getirdi. 1870'lere gelindiğinde, yüksek tüketici talebine sahip bir ürün olan elektrikli çanlar için devreler üretiliyordu. 1900 yılına gelindiğinde, el feneri icat edildi ve yılda iki milyondan fazla pil üretildi. Teknolojinin büyümesi, piller için yüksek bir talep sağlamaya devam etti. Kimyasal reaksiyonlarla üretilen elektrik enerjisi, modern toplumda çeşitli uygulamalarda kullanılmaktadır. Şekil 5'e bakın.
Çoğu araç, benzinli ve dizel motorlarını çalıştırmak için akülere bağımlıdır. Benzinli motorlardan çıkan dumanların zararlı olabileceği alanlarda kullanılan forkliftler genellikle pille çalışır. EV uygulamaları için daha verimli piller üzerinde araştırmalar devam ediyor. CD çalarlar gibi taşınabilir ses sistemleri pil kullanır. Çoğu taşınabilir elektronik test cihazı, elektronik devrelerine güç sağlamak için pil kullanır. Yaygın olarak kullanılan elektrikli kol saatleri ve masaüstü bilgisayarlar, tarih ve saat işlevlerini sürdürmek için piller tarafından sağlanan enerjiye güvenir. Cep telofonları tamamen pil gücüyle çalışır. Taşınabilir ( dizüstü bilgisayar ) bilgisayarlar tamamen pil gücüyle çalıştırılabilir.