Kimyada Elektrot Potansiyelleri
Elektrokimyada elektrot potansiyeli, iki elektrottan oluşan bir hücrenin elektromotor kuvvetidir.
E işareti ile gösterilir. Tek elektrot potansiyelinin mutlak değerini doğrudan doğru bir şekilde ölçmek mümkün değildir. Sadece iki elektrot arasındaki potansiyel farkı deneysel olarak ölçülebilir. Bu nedenle, elektrot potansiyelini ölçmek için yapılan bir deneyde, bir hücrede, potansiyeli zaten bilinen bir referans elektrot olarak bir elektrot kullanılır ve potansiyeli bilinmeyen başka bir elektrot kullanılır. Hücre potansiyeli, iki elektrot üzerindeki potansiyellerin toplamına eşit olan deneysel olarak ölçülür.
EHücresi = EKatot + EAnot
EHücre deneysel olarak voltametre ile ölçülür ve bir elektrotun elektrot potansiyeli zaten bilinir, bu nedenle diğerinin elektrot potansiyeli ( elektrot potansiyeli bilinmeyen elektrot ) hesaplanabilir.
Standart Elektrot Potansiyeli Nedir?
Standart koşullar altında standart hidrojen elektroduna karşı ölçülen yarı reaksiyonun ( yarım hücre ) potansiyeli, o yarı hücre veya yarım reaksiyon için standart elektrot potansiyeli olarak adlandırılır. Standart koşullar 298 °K'da sıcaklık anlamına gelir, basınç 1 atm, kullanılan elektrolit konsantrasyonu 1M olmalıdır. Standart hidrojen elektrotlarına göre ölçülür.
Standart hidrojen elektrotu bir gaz – iyon elektrotudur. Elementlerin ve diğer yarım hücrelerin standart elektrot potansiyelinin belirlenmesi için referans elektrot olarak kullanılır. Anot yarı hücreli ve katot yarı hücreli olarak işlev görebilir. Standart indirgeme potansiyeli ve standart oksidasyon potansiyelinin değeri 25 °C veya 298 °K'da her zaman sıfırdır. Oksidasyon - indirgeme potansiyellerinin termodinamik ölçeğinin temelidir.
Standart elektrot potansiyeli E0 ile gösterilir. Standart bir hidrojen elektrotu kullanılarak bir elektrot için Standart indirgeme potansiyeli veya standart oksidasyon potansiyeli hesaplanabilir. Standart hücre potansiyeli, iki yarı hücrenin veya yarı reaksiyonun standart indirgeme potansiyelleri arasındaki farktır. Şu şekilde temsil edilebilir:
E0Hücresi = Ekatot – Eanot
Çinko Elektrot için Standart İndirgeme Potansiyelinin Hesaplanması
- Burada, standart bir hidrojen elektroduna karşı çinko sülfat ( elektrolit ) içeren bir yarım hücrede bir çinko elektrot alarak standart indirgeme potansiyelini hesaplama yöntemini açıklıyoruz. Standart indirgeme potansiyeli ve standart hidrojen potansiyeli için standart oksidasyon potansiyeli her zaman 0.00 alınır. Deney aşağıda açıklanmıştır-
- Standart hidrojen elektrodunun yapısı - Standart bir hidrojen elektrot oluşturmak için, bir cam beherde 1M'lik bir hidrojen klorür çözeltisi alıyoruz. Şimdi bir ucunda platin siyah folyo bulunan platin inert bir elektrot behere daldırılır ve oksijen girişini önlemek için üzerinde bir cam kılıf tutulur. Saf hidrojen gazının ( 1atm ) çözeltiye girmesi için bir girişi vardır. Sıcaklık 25°C'de tutulur.
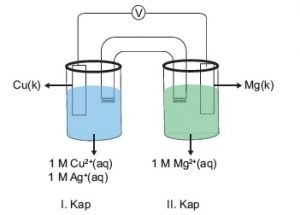
- Standart hidrojen elektrodunun bu yarım hücresi, yarım çinko elektrot hücresi ile bağlanır. Bunun için bir behere çinko sülfat alınır ve içine bir çinko çubuk batırılır. 1M konsantrasyonda elektrolit çinko sülfat alınır. Sıcaklık 25°C'de tutulur. Şimdi, bu çinko elektrot, hücrenin elektrot potansiyelini ölçecek bir voltmetre kullanılarak standart bir hidrojen elektroduna bağlanır. Çözeltilerin birbirine karışmasını önleyen ve çözeltilerin elektriksel nötrlüğünü koruyan bir tuz köprüsü de kullanılır. Katot olarak çinko yarım hücresi, anot olarak hidrojen yarım hücresi alınır.
- Bildiğimiz gibi, standart hidrojen elektrodunun standart indirgeme potansiyeli standart koşullarda her zaman 0 olarak alınır ve deneyde standart koşulları kullanıyoruz. Yani, E0 +H / H2 = 0
- Hücrenin standart indirgeme potansiyelinin değeri, kullanılan voltmetrenin okunması ile ölçülür. Böylece, deney ile E0Hücresi'in değerini biliyoruz ve E0 +H /H2'nin değeri zaten biliniyor. Böylece, denklem (1) ile E0 2+Zn /Zn değerini hesaplayabiliriz.
- Deney ile E0Hücresi'nin değeri -0.76V'a çıkar. Yani, SHE için standart indirgeme potansiyeli 0 olduğundan E0 2+Zn /Zn değeri -0.76V'dir.
- Aynı yöntemle, çinko elektrot ve çinko sülfat elektrolit yerine bakır elektrot ve bakır sülfat elektrolitli bir yarım hücre kullanarak bakır elektrotun standart indirgeme potansiyelini hesaplayabiliriz. Deney ile E0 2+Cu /Cu değeri +0.34V çıkıyor.
- Daniel hücre gösterimi Zn(s)/Zn2+(aq)||Cu2+(s) / Cu(aq) ve standart koşullar kullanılır, bu elektrolit konsantrasyonları 1M, sıcaklık 298K ve basınç 1 atm'dir. Daha sonra hücre için standart elektrot potansiyelini aşağıdaki gibi hesaplayabiliriz:
E0Hücresi = E0Katot – E0Anot
E0Hücresi = E0 2+Cu /Cu - E0 2+Zn /Zn
( denklemde - yerine + işareti kullanırsanız, oksidasyon elektrotu olarak çinko elektrot yazmanız gerekir, bu şu şekilde yazılacağı anlamına gelir: E0Hücresi = E0 2+Cu /Cu + E0 2+Zn /Zn )
E0Hücresi = +0.34 – (-0.76)
E0Hücresi = 1.1V
Bu nedenle, Daniel hücresinin EMF veya standart hücre potansiyeli 1.1V'dir.
- E0Hücresi'nin pozitif değeri reaksiyonun kendiliğinden gerçekleştiğini, E0Hücresi'nin negatif değeri ise reaksiyonun ters yönde kendiliğinden ilerlediğini gösterir.
- Referans elektrot olarak kullanılan standart hidrojen elektrodu, analiz edilecek çözeltinin özelliklerinden etkilenmemeli ve fiziksel olarak izole edilmelidir. Standart hidrojen elektrotlarının yanı sıra, kalomel elektrotlar, kinhidron elektrotlar vb. gibi birçok başka elektrot referans elektrot olarak kullanılır.
Elektrokimyasal Seri
Elementlerin standart elektrot potansiyel değerlerine göre düzenlenmesine elektrokimyasal seriler denir. Aynı zamanda etkinlik serisi olarak da adlandırılır. Daha yüksek standart elektrot potansiyeline sahip elemanlar, daha düşük standart elektrot potansiyeline sahip olanların üzerine yerleştirilir. Serinin en üstüne yerleştirilen elemanlar kolayca küçülme eğilimindedir. En alta yerleştirilen elemanlar ise en az azalma eğilimine sahiptir.
Flor, en yüksek standart elektrot potansiyeline sahip olduğu için maksimum azalma eğilimine sahiptir. Lityum, standart elektrot potansiyelinin en düşük değerine sahip olduğu için en az azalma eğilimine sahipken. Bu nedenle, flor güçlü bir oksitleyici ajandır ve lityum güçlü bir indirgeyici ajandır.
Standart Elektrot Potansiyellerinin Kullanım Alanları
Standart elektrot potansiyellerinin kullanımları aşağıda listelenmiştir –
- Çeşitli oksidanların ve indirgeyicilerin nispi güçlerini ölçmek için kullanılır.
- Standart hücre potansiyelini hesaplamak için kullanılır.
- Olası reaksiyonları tahmin etmek için kullanılır.
- Reaksiyondaki dengenin tahmini.
Standart Elektrot Potansiyellerinin Sınırlandırılması
Standart elektrot potansiyelleri sadece sulu dengeye uygulanabilir. Reaksiyon olasılıklarını tahmin edebiliriz, ancak standart elektrot potansiyellerini kullanarak reaksiyon hızını tahmin edemeyiz.
Bu, standart elektrot potansiyeli ve hesaplamaları hakkında kısa bir bilgiydi ve örneklerle açıklandı. Konsepte odaklanın ve nasıl hesaplandığını anlayın.
Sıkça Sorulan Sorular – SSS
1. Elektrot potansiyeli nedir?
Bir elektrotun potansiyeli, bir katot görevi gören ilgili elektrot ve bir anot görevi gören standart hidrojen elektrotundan oluşan bir hücrenin potansiyeli olarak bilinir. Katot her zaman azalır ve anot oksitlenir.
2. Standart elektrot potansiyeli ile standart hücre potansiyeli arasındaki fark nedir?
Normal hücre potansiyeli veya standart elektrot potansiyeli olarak bilinen bir sınıfta, standart indirgeme potansiyeli mevcuttur. Hücrelerin doğal potansiyeli, katot ve anot arasındaki potansiyel farktır. Tüm standart potansiyeller 298 K, 1 atm ve 1 M çözeltilerde ölçülür.
3. Elektrot potansiyeli neye bağlıdır?
Bir elektrotun elektron kaybetme eğilimine oksidasyon potansiyeli denirken, bir elektrotun elektronları emme eğilimine indirgeme potansiyeli denir. Elektrotların potansiyeli, metal iyonu konsantrasyonuna ve sıcaklığına bağlıdır.
4. Hücre potansiyelini hangi faktörler etkiler?
Sıcaklık, yüzey alanı ve konsantrasyon, kimyasal reaksiyonları etkileyen ana faktörlerdir.
5. Hücre potansiyelini ne artırır?
Elektrolit çözeltilerinden birinin konsantrasyonunu artırarak, katyon ve anyon sayısını artırırsınız ( hangi elektroliti artırdığınıza bağlı olarak ), böylece hücrenin voltaj potansiyelini arttırırsınız.
6. Tersinir elektrot nedir?
Tersinir bir elektrot, potansiyeli tersine çevrilebilen değişikliklere dayanan bir elektrottur. Temel gereksinimlerden biri, sistemin kimyasal dengeye yakın olmasıdır. Sistem ayrıca, kimyasal denge koşullarının neredeyse her zaman geçerli olması için yeterince uzun bir süre boyunca son derece küçük taleplere tabi tutulmalıdır.
Teoride, tersinir koşulların deneysel olarak gerçekleştirilmesi zordur, çünkü sonlu bir zamanda dengeye yakın bir sisteme uygulanan her bozulma onu dengenin dışına zorlar. Ancak, sisteme uygulanan talepler azsa ve yeterince yavaş uygulanırsa, bir elektrot geri dönüşümlü olarak kabul edilir. Elektrot tersine çevrilebilirliği, doğası gereği deneysel koşullara ve elektrotun kullanılma şekline bağlıdır.
7. Standart elektrot potansiyelinin önemi nedir?
Standart elektrot potansiyelinin önemi:
- İki yarı reaksiyondan oluşan redoks reaksiyonları, tüm elektrokimyasal hücrelerin temelini oluşturur.
- Anot, elektron kaybına neden olan oksidasyon yarı reaksiyonuna girer.
- Katotta bir indirgeme reaksiyonu meydana gelir ve bu da elektron kazancı ile sonuçlanır.
- Elektronlar anottan katoda bu şekilde hareket eder.
- Her elektrotun bireysel potansiyellerindeki fark, anot ve katot ( ilgili elektrolitlerine daldırılmış ) arasında elektrik potansiyelinin ortaya çıkmasına neden olur.
8. Standart elektrot potansiyelinin çözünme potansiyeli nedir?
Teorik olarak, hidrojene göre ölçülen standart elektrot potansiyelleri ilgi çekicidir. Alaşımlar için değil, yalnızca saf metaller için geçerlidirler ve alüminyum örneğinde gösterildiği gibi olası pasivasyon işlemlerini hesaba katmazlar. Alışılmadık bir ortamda, yani söz konusu metalin tuzunun standart bir çözeltisinde ölçülürler.
Bunlar, kullanımı kolay bir referans elektrotla ilişkili olarak ve doğal tuzlu su veya standart bir sıvı gibi seçtikleri ortamda ölçülen çözünme potansiyellerini tercih eden korozyon uzmanları için yalnızca sınırlı bir ilgiye sahiptir.