Alkoller, Fenoller ve Eterler
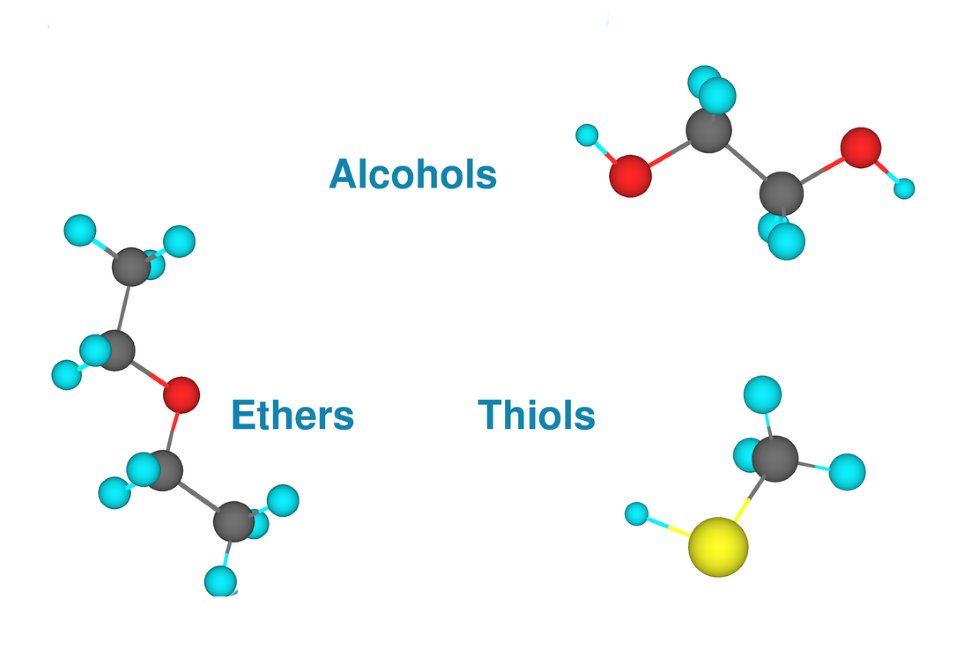
Alkoller, Fenoller ve Eterler
Alkol, Fenoller ve Eterler bölümünde ele alınan ana konular, yapıları, sınıflandırılmaları, isimlendirilmeleri, hazırlanmaları, göze çarpan örneklerle fiziksel ve kimyasal özellikleridir. Bölümün hızlı bir revizyonunu yapmak için bunların karşılaştırmalı bir çalışmasını yapalım. Bu, önemli noktaları, benzerlikleri ve çarpıcı farklılıkları hatırlamaya yardımcı olacaktır.
|
Alkol
|
Fenol
|
Eterler
|
|
Fonksiyonel Grup
|
||
|
Bir alifatik hidrokarbonun hidrojeni, -OH ( hidroksil ) grubu ile değiştirilir |
Aromatik bir hidrokarbonun hidrojeni, -OH ( hidroksil ) grubu ile değiştirilir |
Bir hidrokarbonun hidrojeni, -OR / -OAr ( Alkoksi veya Ariloksi ) grubu ile değiştirilir |
|
Sınıflandırma
|
||
|
Hayır'a bağlı olarak. -OH grubu mevcut, Monohidrik, dihidrik ve polihidrik. C tipine bağlı olarak birincil, ikincil, üçüncül ( sp3 ) -OH'ye bağlı olan Müttefik - OH grubu alilik karbona (sp3), örneğin CH2=CH-CH-OH Benzilik - C'ye bağlı OH grubu ( sp3 ) aromatik bir halkaya bağlı Vinil - C'ye bağlı OH grubu ( sp2 ) C=C ile, örneğin CH2=CH-OH |
Hayır'a bağlı olarak. -OH grubu mevcut, Monohidrik, dihidrik ve polihidrik |
Simetrik ( Basit ) – O'ya bağlı aynı gruplara (alkil / aril) sahip olmak Simetrik olmayan ( Karışık ) – O'ya bağlı farklı gruplar |
|
Adlandırma
|
||
|
Ortak Ad – alkil grubunun adına eklenen 'alkol', örneğin metil alkol, etil alkol, vb. IUPAC – Alkan adına eklenen son ek – 'ol', örneğin metanol ( CH3OH ), etanol ( C2H5OH ), vb. |
En basiti fenol C6H5OH. Yaygın isimdir ve IUPAC terminolojisinde de kabul edilir OH grubunun konumu o ( orto ), m (meta), p ( para ) veya siklik karbonlar vb. numaralandırılarak gösterilir. Örneğin o-Kresol 2-Metilfenoldür, Katekol Benzen-1,2-dioldür, vb. |
Ortak Ad – 'eter' kelimesi, alkil gruplarının adını alfabetik sırayla takip eder, örneğin Etilmetil eter, Dietil eter, vb. IUPAC Adı – Hidrokarbonun alkoksi veya ariloksi türevi olarak adlandırılır. Daha hacimli grup, ana hidrokarbon olarak alınır, örneğin Metoksimetan, Metoksibenzen, vb. |
|
Yapı
|
||
|
sp3 arasında bir bağ vardır C ve O'nun hibritleştirilmiş orbitalleri Bağ açısı: C-O-H bağ açısı 108.9°'dir, yani tetrahedral ( 109°-28' ) değerden azdır Elektron Oksijen çiftleri arasındaki itmeden kaynaklanmaktadır Bağ Uzunluğu: C-O bağ uzunluğu Metanolde 142 pm'dir |
sp2 arasında bir bağ vardır aromatik halka ve O'nun C'nin hibritleştirilmiş orbitalleri Bağ açısı: C-O-H bağ açısı Fenol'de 109°'dir Bağ Uzunluğu: C-O bağ uzunluğu Fenol'de 136 pm'dir. sp2 nedeniyle Metanol ile karşılaştırıldığında daha azdır. Karbonun hibridizasyonu ve aromatik halkanın pi elektronlarının konjugasyonu kısmi çift bağ karakteri verir. |
Bağ açısı: C-O-C bağ açısı 111.7'dir ( Metoksimetan ). İki R ( hacimli ) grubu arasındaki itme nedeniyle tetrahedralden daha fazladır Bağ Uzunluğu: C-O bağ uzunluğu 141 pm'dir, neredeyse alkollerle aynıdır |
|
Hazırlık
|
||
|
1. Alkenlerden: a. Asit katalizli hidrasyon H2O ilavesi Markonikov kuralına göre b. Hidroborasyon-oksidasyon ile H2O2 ile oksitlenen trialkil boranlar vermek için diboran ile reaksiyon ve NaOH ( sulu ) Oluşan son ürün Markonikov kuralının tersidir |
1. Haloarenes'ten: Klorobenzen, sodyum fenoksit oluşturmak için NaOH ile muamele edilir ve daha sonra fenol oluşturmak için asitle muamele edilir C6H5Cl + NaOH → |
1. Alkollerin dehidrasyonu ile: Birincil alkoller protik asitlerle ( H2SO4, H3PO4 ) eter, nükleofilik bimoleküler reaksiyon ile oluşur. Bu reaksiyon koşullara bağlıdır, 443 K'da alken ana bir üründür, oysa 413 K'da eter önemli bir üründür Alkol 2° veya 3° olduğunda, eliminasyon reaksiyonu SN1 ile rekabet eder ana ürün olarak alken ile sonuçlanır |
|
2. Karbonil Bileşiklerinden: a. Ni, Pd veya Pt metal katalizörü varlığında katalitik hidrojenasyon veya aldehit ve ketonların LiAlH4 ile indirgenmesi ile veya NaBH4 Aldehitler → birincil alkoller İkincil alkoller → ketonlar b. Karboksilik asitlerin ve esterlerin indirgenmesiyle |
2. Benzen sülfonik Asitten: İlk adım, benzenin oleum ile sülfonasyonudur. Bu şekilde oluşan benzen sülfonik asit, sodyum fenoksit oluşturmak için erimiş NaOH ile ısıtılır ve daha sonra fenolden asitleştirilir |
2. Williamson Sentezi: Eter, sodyum alkoksitin bir alkil halojenür ile reaksiyonunda oluşur 1 ° alkil halojenür ile, SN2 tercih edilir ve eter ana ürün olarak oluşur, ancak 2 ° veya 3 ° eliminasyon ile devam eder ve alken oluşan ana üründür Fenol de bu yöntemle etere dönüştürülebilir |
|
3. Grignard Reaktiflerinden: Aldehit ve ketonların Grignard reaktifi ( R-Mg-X ) ile reaksiyona girmesiyle. Grignard reaktifinin nükleofilik bir ilavesi ve ardından hidroliz vardır HCHO + RMgX → |
3. Diazonyum Tuzlarından: Anilin ( C6H5NH2 ) NaNO2 + HCl ile reaksiyona girdiğinde, Benzen diazonyum klorür ( C6H5N2Cl ), hidrolizde fenol veren |
|
|
4. Cumene'den: Kümen ( izopropilbenzen ), kümen hidroperoksit oluşturmak üzere oksitlenir ve daha sonra fenol oluşturmak için dil ile muamele edilir. Aseton, reaksiyonda bir yan üründür |
||
|
Fiziki ozellikleri
|
||
|
Kaynama noktası: Van der Waals kuvvetlerinin artmasına bağlı olarak C atomlarının sayısındaki artışla artar Yüzey alanı ve Van der Waals kuvvetlerinin azalması nedeniyle dallanmanın artmasıyla azalır Kaynama noktası, moleküller arası hidrojen bağı nedeniyle alkanlar, eterler, haloalkanlar vb. gibi diğer bileşiklere kıyasla daha fazladır |
Kaynama noktası: Kaynama noktası, moleküller arası hidrojen bağı nedeniyle arenler, eterler, haloarenler vb. gibi diğer bileşiklere kıyasla daha fazladır |
Kaynama noktası: Alkollerde moleküller arası hidrojen bağının varlığından dolayı alkollere kıyasla daha az |
|
Çözünürlük: Çözünürlük, H2O ile hidrojen bağlarının oluşumundan kaynaklanmaktadır. Alkil grubunun ( hidrofobik ) boyutundaki artışla çözünürlük azalır |
Çözünürlük: Çözünürlük, H2O ile hidrojen bağlarının oluşumundan kaynaklanmaktadır. Aril grubunun ( hidrofobik ) boyutundaki artışla çözünürlük azalır |
Çözünürlük: Eterin karışabilirliği, su ve eterin O ile bir hidrojen bağının oluşması nedeniyle alkol ve aynı moleküler kütleye sahip alkandan daha fazladır |
|
Asitlik ve Bazlık
|
||
|
Güçlü Bronsted asitleri ve güçlü bir baza elektron bağışlayabilir Asitlik, O-H bağının polaritesinden kaynaklanmaktadır. Elektron salan alkil grupları asitliği azaltır, bu nedenle alkolün asitlik sırası: 1° > 2° > 3° Su, alkollerden daha iyi bir proton donörü veya daha güçlü bir asittir Ayrıca, oksijen üzerindeki paylaşılmamış elektron çiftleri nedeniyle bir proton alıcısı veya Bronsted bazları olarak da işlev görürler |
Güçlü Bronsted asitleri ve güçlü bir baza elektron bağışlayabilir OH grubuna bağlı benzen halkası, elektron çeken bir grup görevi görür. Elektron oksijen çiftleri, benzen halkasının çift bağı ile konjugasyon halindedir ve OH'nin oksijenini pozitif yapar Fenoller, su ve alkollerden daha güçlü asitlerdir Bu, daha kararlı fenoksit iyonu ve daha polar OH bağı ile açıklanabilir Elektron çekme grubu ( -NO2 ) ikame edilmiş fenoller onu daha asidik hale getirir ve Elektron veren gruplar ( alkil ) asitliği azaltır Asitlik sırası: Nitrofenol > Fenol > Kresol > Etanol |
Eterler hidrokarbonlardan daha asidiktir, ancak ketonlardan ve aldehitlerden daha az asidiktir Eterler, Lewis veya Bronsted bazları olarak işlev görebilir. Güçlü asitler tarafından protonasyondan sonra oksonyum iyonu oluştururlar |
|
Kimyasal Reaksiyonlar
|
||
|
1. Alkolün Nükleofil olarak reaksiyona girdiği reaksiyonlar ( O-H bağı bölünmesi ): a. Karşılık gelen alkoksitleri ve H'yi oluşturmak için metallerle reaksiyona2 2R-O-H + 2Na → 2R-O-Na + H2 b. Esterleştirme: Alkoller, esterler oluşturmak için karboksilik asitler, asit anhidritler ve asit klorürler ile reaksiyona girer |
1. Fenolün Nükleofil olarak reaksiyona girdiği reaksiyonlar ( O-H bağ bölünmesi ): a. Fenol, sodyum fenoksit oluşturmak için metal veya aq NaOH ile reaksiyona girer b. Esterleştirme: Fenoller, esterler oluşturmak için karboksilik asitler, asit anhidritler ve asit klorürler ile reaksiyona girer Salisilik asit + Asetik anhidrit → Aspirin ( Asetilsalisilik asit ) |
1. Eterlerde O-H bağı yoktur |
|
2. Alkolün Elektrofil olarak reaksiyona girdiği reaksiyonlar ( C-O bağ bölünmesi ): a. Alkil halojenürler oluşturmak için HX ile reaksiyon. Bu, 1°, 2° ve 3° alkoller arasında ayrım yapmak için Lucas testinin temelini oluşturur. 3° alkoller kolayca halojenür oluşturur, böylece bulanıklık hemen üretilir b. PX3 ile reaksiyon alkil halojenürler oluşturmak için c. Protik asit varlığında alken oluşturmak için dehidrasyona tabi tutulur, ör. etanol H2SO4 ile reaksiyona girdiğinde etilen oluşturur 443 K'da 2° ve 3° alkoller nispeten daha hafif koşullarda dehidrasyona uğrar. Dehidrasyon sırası: 3° > 2° > 1° d. Aldehitler ve ketonlar oluşturmak için oksidasyon veya Dehidrojenasyon reaksiyonu Birincil alkoller aldehitleri oluşturur Güçlü oksitleyici ajanlar ( KMnO4 ), doğrudan karboksilik asit oluşturur CrO3 ve aldehitleri elde etmek için PCC ( pirimidin klorokromat ) kullanılır İkincil alkoller, CrO3 ile oksidasyon üzerine ketonlar oluşturur Üçüncül alkoller oksidasyona uğramaz. KMnO4 ile tedavi hakkında daha yüksek bir sıcaklıkta, C-C bağının ayrışması gerçekleşir ve bu da daha az karbon atomlu bir karboksilik asit karışımı ile sonuçlanır e. Alkoller ayrıca 573 K'de Cu ile ısıtıldığında dehidrojenasyona uğrar. 1° alkol → Aldehit 2° alkol → Keton 3° alkol → Alken ( Dehidrasyon ) |
2. C-O bağ bölünmesinin olduğu reaksiyonlar: Fenol, benzen oluşturmak için Zn tozu ile reaksiyona girer C6H5OH + Zn → C6H6 + ZnO |
2. C-O bağ bölünmesinin olduğu reaksiyonlar: Eterler nispeten daha az reaktiftir. C-O bağı bölünmesi sert koşullar altında gerçekleşir Dialkil eterler, HX ile reaksiyona girdiğinde iki alkil halojenür ortaya çıkarır Alkil aril eterler HX ile reaksiyona girdiğinde, aril-oksijen bağının daha fazla stabilitesi nedeniyle fenol ve alkil halojenür oluştururlar HX'in reaktivite sırası HI > HBr > HCl |
|
3. Elektrofilik ikame: Fenolde, elektrofilik aromatik sübstitüsyon orto ( o ) ve para ( p ) pozisyonunda gerçekleşir a. Dil. HNO3 ile nitrasyon 298 K'de o- ve p-Nitrofenollerin karışımını verir p-Nitrofenol, moleküller arası hidrojen bağı nedeniyle daha az uçucudur. o-Nitrofenolde molekül içi hidrojen bağı mevcuttur Conc. HNO3 ile nitrasyon Pikrik asit ( 2,4,6-trinitrofenol ) oluşturur b. Halojenasyon: monosübstitüe fenoller CS2 varlığında oluşur veya CHCl3 Brom suyu ile muamele edildiğinde, 2,4,6-tribromofenolün beyaz çökeltisi oluşur Kolbe'nin Tepkisi Fenol, sodyum fenoksit oluşturmak için NaOH ile reaksiyona girer Salisilik asit ( 2-Hidroksibenzoik asit ), sodyum fenoksit CO2 ile reaksiyona girdiğinde elektrofilik ikameye uğradığında oluşur Reimer-Tiemann Reaksiyonu C6H5OH + CHCl3 + aq NaOH → C6H5CHO ( Salisilaldehit ) -CHO grubu fenolde o- pozisyonuna bağlıdır Oksitlenme Fenol, Na2Cr2O7 varlığında oksitlenir ve H2SO4 Benzokinon oluşturmak için |
3. Elektrofilik ikame: Aril eterlerde ayrıca elektrofilik aromatik sübstitüsyon orto ( o ) ve para ( p ) pozisyonunda gerçekleşir Friedel El Sanatları Tepkisi: Halojenasyon ve Nitrasyon o ve p pozisyonunda gerçekleşir Anisol, AlCl3 varlığında alkil veya asil halojenür ile reaksiyona girer ( susuz ) O ve P ikameli ürün verir |
|
Bazı Önemli Alkoller ve Eterler
|
Ad |
Yaygın İsim |
Kimyasal formül |
Hazırlık |
Özellikleri ve Kullanımı |
|
Metanol |
Ahşap ruhu |
CH3OH |
CO'nun katalitik hidrojenasyonu ( karbon monoksit ) |
Çok zehirli Boya ve verniklerde kullanılır |
|
Etanol |
Etil alkol |
C2H5OH |
Glikoz ve şekerin zima ve invertaz gibi enzimler tarafından fermantasyonu |
Endüstrilerde şarap ve diğer alkollü içeceklerin yapımında kullanılır Etanol ayrıca dezenfektanlarda ve boya endüstrisinde de kullanılmaktadır |
|
Fenol |
C6H5OH |
Kümenden ve benzen ve toluenin oksidasyonundan hazırlanır |
Çeşitli önemli bileşikler, plastik ve diğer polimerler için öncü Antiseptik olarak kullanılır |
|
|
Metoksibenzen |
Anisol |
CH3OC6H5 |
Sodyum fenoksit ve metil halojenürden Williamson sentezi ile hazırlanır |
Anason tohumu gibi kokuyor Parfüm ve ilaçların öncüsüdür |