Moleküler geometri nedir?
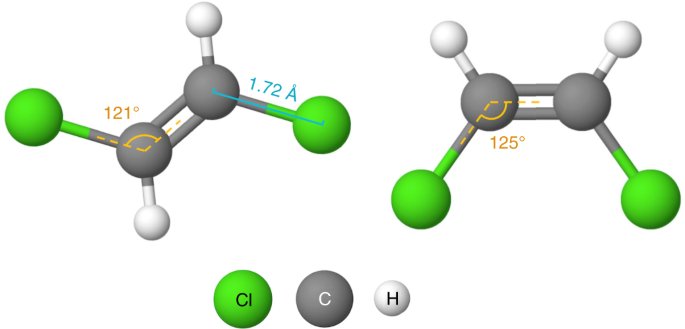
Bir molekülü oluşturan atomların üç boyutlu dizilişini inceleyen bilime Moleküler geometri denir .
Moleküler geometri, molekülün genel şeklinin yanı sıra bağ uzunlukları, bağ açıları, burulma açıları ve her atomun konumunu belirleyen diğer geometrik parametreler hakkında bilgi verir.
Kovalent moleküllerde bağlar yönlü niteliktedir çünkü paylaşılan elektron çiftleri, katılan atomların çekirdekleri arasında belirli bir alanda lokalize halde kalır. Kovalent bir moleküldeki farklı bağları temsil eden noktaların birleştirilmesiyle elde edilen uzay modeli, onun şeklini açıklar.
Moleküler geometrinin belirlenmesi
Moleküler geometri çeşitli spektroskopik yöntemler ve kırınım yöntemleriyle belirlenebilir. IR, mikrodalga ve Raman spektroskopisi, bu tekniklerle tespit edilen titreşim ve dönme absorbansının detaylarından molekül geometrisi hakkında bilgi verebilir. X-ışını kristalografisi, nötron kırınımı ve elektron kırınımı, çekirdekler arasındaki mesafeye ve elektron yoğunluğunun konsantrasyonuna bağlı olarak kristalin katılar için moleküler yapı verebilir.
Bir moleküldeki çeşitli atomlar arasındaki mesafeyi ve ayrıca ilgili bağın açısını belirlemek için çeşitli yöntemler geliştirilmiştir. Bununla birlikte, kovalent moleküllerin geometrileri ve gözlemlenen şekli, değerlik kabuğu elektron çifti itme teorisi ( VSEPR teorisi ) yardımıyla teorik olarak tahmin edilebilir .
VSEPR teorisinin temel özellikleri şunlardır:
- Bir molekülün şekli, merkez atomun etrafındaki değerlik kabuğu elektron çiftlerinin ( bağlı veya bağlı olmayan ) sayısına bağlıdır.
- Değerlik kabuğundaki elektron çiftleri, elektron bulutları negatif yüklü olduğundan birbirlerini iterler.
- Elektron çiftlerinin merkez atom etrafındaki uzaydaki konumları, itmeyi en aza indirecek ve böylece aralarındaki mesafeyi maksimuma çıkaracak şekildedir.
- Farklı elektronik itme türlerinin büyüklükleri aşağıda verilen sırayı takip eder:
Yalnız çift – Yalnız çift > Yalnız çift – Bağlanan çift > Bağlanan çift – Bağlanan çift
- Bu itici kuvvetler molekülün veya iyonun bağ açılarını değiştirir.
- İki elektron çifti arasındaki elektronik itme, birbirlerinden olabildiğince uzak olmaları durumunda minimum olacaktır. Bu temelde aşağıdaki geometrik düzenlemeler en uygunudur.
Moleküler geometri türleri.
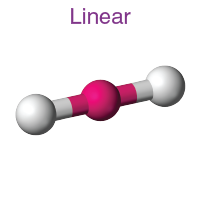
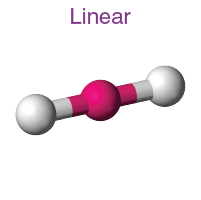
( i ) Doğrusal moleküler geometri:
- Bu yapıda merkez atoma iki molekül bağlanır. Böylece itilmelerini en aza indirmek için ters yönde dizilmişlerdir.
- Bu yapının bağ açısı 180°' dir .
- Örnek: BeCl2 , MgCl2 vb.
( ii ) Üçgen düzlemsel moleküler geometri:
- Bu tür molekülde merkezi bir atoma bağlı üç molekül buluruz. Böylece itmelerini en aza indirmek için eşkenar üçgenin köşelerine doğru düzenlenirler .
- Bu yapının bağ açısı 120°' dir.
- Örnek: BF3 , BCl3 , AlF3 vb.
( iii ) Tetrahedral moleküler geometri:
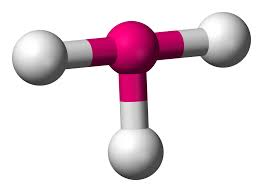
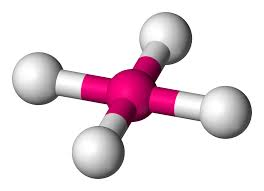
- Dört yüzlü moleküler geometride, merkezde bir merkezi atom ve dört yüzlünün köşelerinde yer alan dört ikame edici bulunur.
- Yapının bağ açısı 109° 28' dir.
- Örnek: CH4, CCl4 vb .
( iv ) Üçgen Bipiramidal moleküler geometri:
- PF 5 örneğini ele alalım . Burada, elektronların üçgen piramidin köşesine doğru eşit şekilde dağıtılmasıyla itme en aza indirilebilir. Üçgen çift piramitte molekülün ekvatoru boyunca üç konum bulunur. İki konum ekvator düzlemine dik bir eksen boyunca uzanır.
- Bağ açısı 90° ve 120°'dır
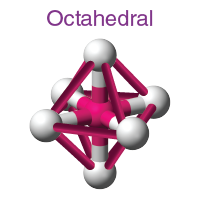
( v ) Oktahedral moleküler geometri:
- Oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atom veya atom grubu veya ligand içeren bileşiklerin şeklini tanımlar .
- Bağ açısı 90°' dir .
- Örnek: SF6, TeF6 vb.
Molekülün düzenli ve düzensiz geometrisi
VSEPR teorisine göre kovalent moleküller, doğası gereği düzenli ve düzensiz olmak üzere iki tür geometriye sahiptir.
Düzenli geometri:
Kovalent moleküllerin geometrisi, merkezi atom benzer atomlara sahip tüm elektron bağ çiftleri tarafından çevrelenmişse düzenlidir. Bağ çiftlerindeki itici etkileşimler karşılıklı olarak birbirini dengeler.
Düzensiz geometri:
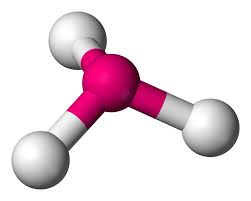
Bu durumda merkezi atom ya farklı atomlara sahip bağ çiftleri ( CHCl3 ) ya da hem bağ çiftleri hem de yalnız elektron çiftleri ( H2O, NH3 ) ile çevrelenir, bu durumda itici etkileşimler birbirini karşılıklı olarak dengelemez. Bu koşullar altında moleküllerin geometrilerinin düzensiz veya çarpık olduğu söylenir .
VSEPR teorisine dayalı bazı kovalent moleküllerin geometrisi
| Moleküler Tip | Bağ çifti sayısı | Yalnız çift sayısı | Molekül geometrisi | Molekülün şekli | Örnekler |
|---|---|---|---|---|---|
| AB2 | 2 | 0 | 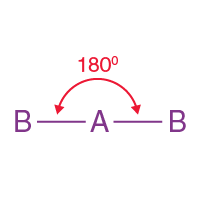
Doğrusal |
 |
BeF2, BeCl2 |
| AB3 | 3 | 0 | 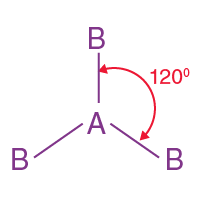 Üçgensel düzlem |
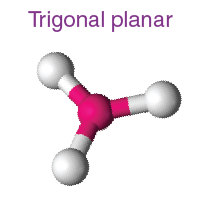 |
BF3, BCl3 |
| AB2L | 2 | 1 | 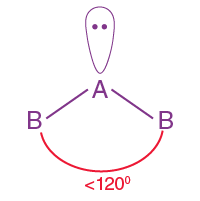 Üçgensel düzlem |
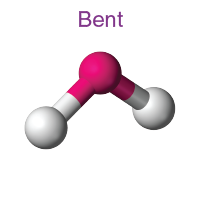 Üçgensel düzlem |
SO2 |
| AB4 | 4 | 0 | 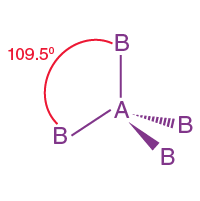 dörtyüzlü |
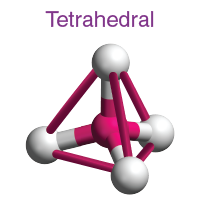 |
CH4, CCl4 |
| AB3L | 3 | 1 | 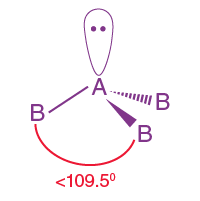 dörtyüzlü |
Piramidal
|
NH3 |
| AB2L2 | 2 | 2 | 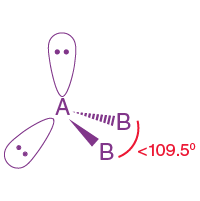 dörtyüzlü |
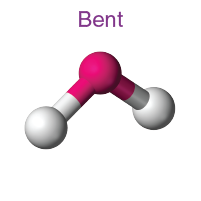 |
H20 |
| AB5 | 5 | 0 | 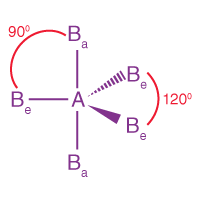 Üçgen çift piramidal |
I
|
PF5 |
| AB4L | 4 | 1 | 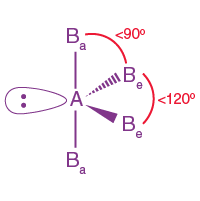 Üçgen çift piramidal |
 |
SF4 |
| AB3L2 | 3 | 2 | 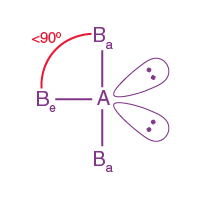
Üçgen çift piramidal |
T şeklinde
|
ClF3 |
| AB2L3 | 2 | 3 | 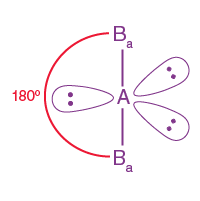
Üçgen çift piramidal |
 |
XeF2 |
| AB6 | 6 | 0 | 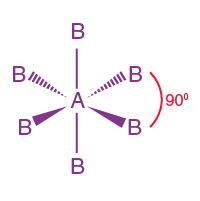 oktahedral |
oktahedral
|
SF6, TeF6 |
| AB5L | 5 | 1 | 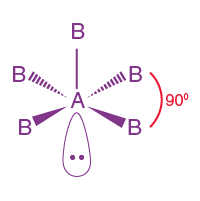 oktahedral |
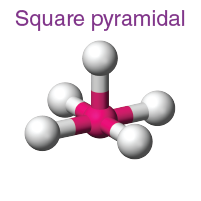 |
CIF5 |
| AB4L2 | 4 | 2 | 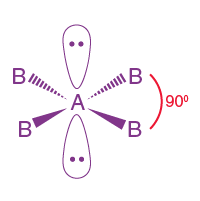 oktahedral |
Kare düzlemsel
|
XeF4 |
Moleküler Geometri Hakkında Sıkça Sorulan Sorular
1. 5 moleküler geometri nedir?
5 moleküler geometri doğrusal , trigonal düzlemsel , tetrahedral , trigonal bipiramidal ve oktahedraldir .
2. H2O'nun moleküler geometrisi nedir ?
H2O molekülünde oksijen merkez atomdur. Oksijenin değerlik elektronu altıdır. Bu elektronlardan ikisi, iki hidrojen atomuyla bağ oluşturur. Böylece H2O'da merkez atom iki bağ çifti ve iki yalnız çift elektron içerir. Yani geometri tetrahedral ama şekil bükülmüş.
3. PH3'ün moleküler geometrisi nedir ?
PH3 molekülü tetrahedral bir geometriye sahiptir. Merkezi P atomu üç bağ çifti elektronu ve bir yalnız çift elektronu içerir.
4. Bir molekülün geometrisi nedir?
Moleküler geometri, bir molekülü oluşturan atomların üç boyutlu düzenidir. Molekülün genel şeklinin yanı sıra bağ uzunlukları, bağ açıları, burulma açıları ve her atomun konumunu belirleyen diğer geometrik parametreler hakkında bilgi verir.
5. Elektron geometrisi ile moleküler geometri arasındaki fark nedir?
Moleküler geometri, bir moleküldeki atomların normalde tek bir merkezi atoma göre 3 boyutlu düzenlenmesi olarak tanımlanır. Oysa elektron geometrisi, ister bağlı olsun ister olmasın, merkezi bir atom etrafındaki elektron çiftlerinin 3 boyutlu düzenlenmesidir .