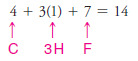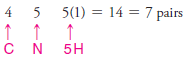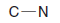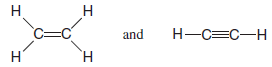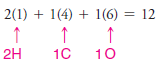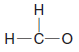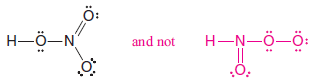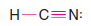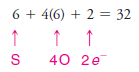Lewis Yapıları: Tanım, Yapısal Formül, Örnekler
Lewis Yapıları: Tanım, Yapısal Formül, Örnekler
- BİLİM ve TEKNOLOJİ
- Wed, 7 Aug 2024 16:33:11
- Wed, 7 Aug 2024 16:33:11
Lewis yapılarının tanımı
– Lewis yapısı, atomların etrafındaki elektron konumlarını göstermek için noktaların kullanıldığı ve çizgilerin veya nokta çiftlerinin atomlar arasındaki kovalent bağları temsil ettiği bir molekülün yapısal bir temsilidir.
– Bir Lewis nokta yapısı çizmenin amacı, kimyasal bağ oluşumunu belirlemeye yardımcı olmak için moleküllerdeki yalnız elektron çiftlerini tanımlamaktır.
– Kovalent bağlar içeren moleküller ve koordinasyon bileşikleri için Lewis yapıları yapılabilir.
– Bunun nedeni, elektronların kovalent bir bağda paylaşılmasıdır. İyonik bir bağda, bir atomun diğer atoma bir elektron bağışlaması gibidir.
– Lewis yapıları, 1916'da ‘Atom ve Molekül’ makalesinde bu fikri ortaya atan Gilbert N. Lewis'in adını almıştır.
Lewis yapıları nasıl yazılır
– Uygun Lewis yapıları çizmemize izin veren birkaç basit kural vardır:
Lewis yapılarını yazmak için kural ( 1 )
( 1 ) Lewis yapıları, yalnızca ilgili atomların değerlik elektronlarını kullanarak bir molekül veya iyondaki atomlar arasındaki bağlantıları gösterir.
Değerlik elektronları, bir atomun en dış kabuğunun elektronlarıdır.
Lewis yapılarını yazmak için kural ( 2 )
( 2 ) Ana grup elementleri için, nötr bir atomun bir Lewis yapısına getirdiği değerlik elektronlarının sayısı, periyodik tablodaki grup numarası ile aynıdır.
– Örneğin karbon, IVA grubundadır ve dört değerlik elektronuna sahiptir; halojenler ( örneğin, flor ) grup VIIA'dadır ve her birinin yedi değerlik elektronu vardır; hidrojen IA grubundadır ve bir değerlik elektronuna sahiptir.
Kural ( 3 )
( 3 ) Çizdiğimiz yapı negatif bir iyon ( bir anyon ) ise, orijinal değerlik elektron sayısına her negatif yük için bir elektron ekleriz.
– Yapı pozitif bir iyon ( katyon ) ise, her pozitif yük için bir elektron çıkarırız.
Kural ( 4 )
( 4 ) Lewis yapılarını çizerken, her atoma bir soy gazın elektron konfigürasyonunu vermeye çalışırız.
– Bunu yapmak için, atomların kovalent bağlar oluşturmak için elektronları paylaştığı veya iyonlar oluşturmak için elektronları aktardığı yapılar çizeriz.
( a ) Hidrojen, elektronunu başka bir atomun elektronuyla paylaşarak bir kovalent bağ oluşturur, böylece soy gaz helyumundakiyle aynı sayıda iki değerlik elektronuna sahip olabilir.
( b ) Karbon, dört değerlik elektronunu diğer atomlardan gelen dört değerlik elektronuyla paylaşarak dört kovalent bağ oluşturur, böylece sekiz elektrona sahip olabilir ( neonun elektron konfigürasyonu ile aynı, oktet kuralını sağlar ).
( c ) Bir değerlik elektron sekizlisi elde etmek için, azot, oksijen ve halojenler gibi elementler tipik olarak kovalent bağ yoluyla değerlik elektronlarının yalnızca bir kısmını paylaşır, diğerlerini paylaşılmamış elektron çiftleri olarak bırakır.
Çözülmüş Problemler
– Aşağıdaki problemler yukarıdaki kuralları göstermektedir.
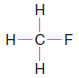
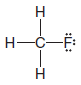
Çözülen problem ( 1 ): CH3F'nin Lewis yapısını yazın.
Strateji ve Cevap:
1. Tüm atomların toplam değerlik elektron sayısını buluyoruz:
2. Birbirine bağlı tüm atomlar arasında bağ oluşturmak için elektron çiftleri kullanırız.
– Bu bağ çiftlerini çizgilerle temsil ediyoruz.
– Örneğimizde, bu dört çift elektron gerektirir ( 14 değerlik elektronunun 8'i ).
3. Daha sonra kalan elektronları çiftler halinde ekleyerek her hidrojene 2 elektron ( bir düet ) ve diğer her atoma 8 elektron ( bir sekizli ) veririz.
– Örneğimizde, kalan 6 değerlik elektronunu üç bağ yapmayan çift halinde flor atomuna atıyoruz.
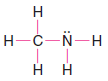
Çözülmüş problem ( 2 ): Metilamin ( CH3NH2 ) için bir Lewis yapısı yazın.
Strateji ve Cevap:
1. Tüm atomlar için toplam değerlik elektron sayısını buluruz.
2. Karbon ve nitrojeni birleştirmek için bir elektron çifti kullanıyoruz.
3. Karbon ve üç hidrojen atomu arasında tek bağlar oluşturmak için üç çift kullanıyoruz.
4. Azot atomu ile iki hidrojen atomu arasında tekli bağlar oluşturmak için iki çift kullanırız.
5. Bu, nitrojen atomu üzerinde yalnız bir çift olarak kullandığımız bir elektron çifti bırakır.
Kural ( 5 )
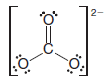
( 5 ) Gerekirse, oktet kuralını sağlamak için birden fazla bağ kullanırız ( yani, atomlara soy gaz konfigürasyonunu veririz ).
– Karbonat iyonu ( CO32- ) bunu göstermektedir:
– Organik moleküller eten ( C2H4 ) ve etin ( C2H2 ), daha önce de belirtildiği gibi, sırasıyla ikili ve üçlü bir bağa sahiptir:
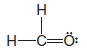
Çözülen problem ( 3 ): CH2O 'nun ( formaldehit ) Lewis yapısını yazın.
Strateji ve Cevap:
1. Tüm atomların toplam değerlik elektron sayısını bulun:
2. ( a ) Tek bağlar oluşturmak için elektron çiftleri kullanın
( b ) Hangi atomların zaten tam bir değerlik kabuğuna sahip olduğunu ve hangilerinin olmadığını ve şimdiye kadar kaç tane değerlik elektronu kullandığımızı belirleyin.
– Bu durumda 6 değerlik elektronu kullandık ve değerlik kabuğu hidrojen atomları için dolu, ancak karbon ve oksijen için dolu değil.
( c ) Oktet kuralını aşmamaya dikkat ederek, değerlik kabuğu henüz dolmamış herhangi bir atomun değerlik kabuğunu doldurmak için kalan elektronları bağlar veya paylaşılmamış elektron çiftleri olarak kullanırız.
– Bu durumda ilk 12 değerlik elektronundan 6'sı kullanıma bırakılır.
– Karbonun değerlik kabuğunu oksijene başka bir bağ ile doldurmak için 2 elektron kullanıyoruz ve kalan 4 elektronu oksijenle paylaşılmamış iki elektron çifti olarak değerlik kabuğunu dolduruyoruz.
Kural ( 6 )
( 6 ) Bazı Lewis yapılarını yazmadan önce, atomların birbirine nasıl bağlı olduğunu bilmeliyiz.
– Örneğin nitrik asidi düşünün.
– Nitrik asit formülü genellikle HNO3 olarak yazılsa da, hidrojen aslında nitrojene değil oksijene bağlıdır.
– Yapı HONO2 'dir ve HNO3 değildir.
– Böylece doğru Lewis yapısı şu şekildedir:
Çözülmüş problem ( 4 ): Atomların formülde yazıldıkları şekilde bağlandığını varsayalım ve toksik gaz hidrojen siyanür ( HCN ) için bir Lewis yapısı yazın.
Strateji ve Cevap:
1. Tüm atomlardaki toplam değerlik elektron sayısını buluruz:
2. Hidrojen atomu ile karbon atomu arasında tek bir bağ oluşturmak için bir çift elektron kullanırız ( aşağıya bakın ) ve karbon atomu ile nitrojen atomu arasında üçlü bir bağ oluşturmak için üç çift kullanırız. Bu iki elektron bırakır.
– Bunları nitrojen atomu üzerinde paylaşılmamış bir çift olarak kullanıyoruz.
– Artık her atom bir soy gazın elektronik yapısına sahiptir.
– Hidrojen atomunun iki elektronu vardır ( helyum gibi ) ve karbon ve nitrojen atomlarının her birinin sekiz elektronu vardır ( neon gibi ).
Oktet Kuralının İstisnaları
( 1 ) Atomlar, yalnızca inert gazın konfigürasyonunu elde etmek için değil, aynı zamanda elektronları paylaşmak, pozitif çekirdekler arasında artan elektron yoğunluğu ürettiği için elektronları paylaşır.
– Elektronlar için ortaya çıkan çekirdek çekici kuvvetler, atomları bir arada tutan "yapıştırıcı"dır
– Periyodik tablonun ikinci periyodunun elementleri en fazla dört bağa sahip olabilir ( yani etraflarında sekiz elektron bulunur ) çünkü bu elementlerin bağlanma için mevcut olan yalnızca bir 2s ve üç 2p orbitali vardır.
( 2 ) Her orbital iki elektron içerebilir ve bu orbitalleri toplam sekiz elektron doldurur Bu nedenle oktet kuralı yalnızca bu elementler için geçerlidir ve burada bile, berilyum ve bor bileşiklerinde göreceğimiz gibi, sekizden az elektron mümkündür.
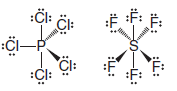
– Üçüncü periyot ve sonrasının elemanları, bağ için kullanılabilecek d orbitallerine sahiptir.
( 3 ) Bu elementler değerlik kabuklarında sekizden fazla elektron barındırabilir ve bu nedenle dörtten fazla kovalent bağ oluşturabilir.
– Örnekler PCl5 ve SF6 gibi bileşiklerdir.
– ( Kesikli takozlar ) olarak yazılan tahviller, kağıdın düzleminin arkasına doğru projelendirilir.
– Kağıdın önünde ( katı takozlar ) projesi olarak yazılan tahviller.
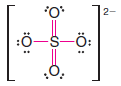
Çözülmüş problem ( 5 ): Sülfat iyonu için bir Lewis yapısı yazın ( S042- ) ( Not: Kükürt atomu dört oksijen atomunun tümüne bağlıdır. )
Strateji ve Cevap:
1. İyona çift negatif yük vermek için gereken ekstra 2 elektron dahil olmak üzere toplam değerlik elektron sayısını buluyoruz:
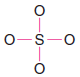
2. Kükürt atomu ile dört oksijen atomu arasında bağ oluşturmak için dört çift elektron kullanıyoruz
3. Kalan 24 elektronu oksijen atomları üzerinde paylaşılmamış çiftler olarak ve kükürt atomu ile iki oksijen atomu arasında çift bağ olarak ekliyoruz.
– Bu, her oksijene 8 elektron ve kükürt atomuna 12 elektron verir:
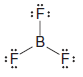
( 4 ) Bazı yüksek reaktif moleküller veya iyonlar, dış kabuklarında sekizden az elektrona sahip atomlara sahiptir.
– Bir örnek bor triflorürdür ( BF3 ).
– Bir BF3 molekülünde, merkezi bor atomunun etrafında sadece altı elektron bulunur: