Organik Formüllerin Çizilmesi ve Yorumlanması
Organik Formüllerin Çizilmesi ve Yorumlanması
- BİLİM ve TEKNOLOJİ
- Wed, 24 Jul 2024 15:28:57
- Wed, 24 Jul 2024 15:28:57
Organik moleküller büyük olabilir ve birden fazla karbon, hidrojen ve diğer element atomlarını içerebilir. Mimarileri, çeşitli uzunluklarda zincirler ve halka yapıları ile karmaşık olabilir.
Burada gösterilen yapıları göz önünde bulundurun:
Bu yapıların her ikisi de organik moleküllerin temsilidir. Her biri 5 karbon atomu ve 12 hidrojen atomu içerir. Ama farklı görünüyorlar ve öyle oldukları ortaya çıkıyor: bu maddelerin özellikleri benzer ama tam olarak aynı değil.
Soldaki maddenin kaynama noktası 9.5 ºC'dir ve bu da onu oda sıcaklığında bir gaz yapar. Sağdaki maddenin kaynama noktası 28 ºC'dir, bu nedenle oda sıcaklığında bir sıvıdır.
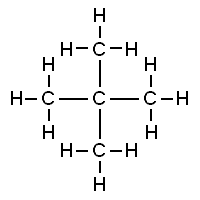
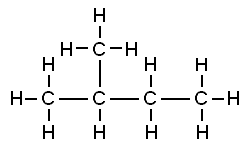
Organik molekülleri düşünmeye ve incelemeye başladığımızda, çok hızlı bir şekilde şu gerçekle karşı karşıya kalırız: moleküler yapılar ( bir moleküldeki atomların sayısını ve türlerini gösteren, örneğin H2O ) bu maddeleri tanımlamak için yetersizdir.
Organik kimyada bu nedenle farklı formül türlerinden yararlanırız. Aşağıdakiler de dahil olmak üzere birkaç tür vardır
- Yapısal formüller: her atomu temel sembolüyle ve bir çizgi olarak çizilen her bağı gösterir. Bunlar, muhtemelen Giriş Kimyası 1'de çizmeyi öğrendiğiniz Lewis Yapılarına çok benziyor, ancak bağ yapmayan elektron çiftleri olmadan.
- Yoğunlaştırılmış yapısal formüller: yapısal formüllere benzer, ancak hidrojen atomlarına gösterilen bağlar yoktur, bu nedenle 3 hidrojenin bağlı olduğu bir karbon bir CH3 olur. Çeşitli yoğunlaştırma düzeyleri vardır ve formüllerin nasıl düzgün bir şekilde yoğunlaştırıldığına ilişkin bazı kurallar vardır. Tüm bu kuralları öğrenmek zor olduğu için bunları yazmaktan daha sık okuyacaksınız.
- İskelet yapıları olarak da adlandırılan hat bağı: Bunlar, burada anlatılanlar arasında öğrenmesi en zor ama çizilmesi en hızlı olanlardır. Kimyasal iletişimde yaygın olarak kullanılırlar. Çizgi bağı yapılarında, karbonlar arasındaki ve karbonlar ile hidrojen dışındaki diğer atomlar arasındaki tüm bağlar gösterilir. Hidrojenler, karbon dışında bir şeye bağlanmadıkça dahil edilmez. Ve karbon atomları element sembolü olmadan gösterilir. Bunun yerine izleyici, çizimde bir tepe noktasının ( sivri yer ) olduğu her yerde ve bir çizginin sonunda karbonu mevcut olarak tanır.
Yukarıdaki yapılar yapısal formüller olarak gösterilmiştir, ancak aynı zamanda yoğunlaştırılmış veya hat bağı yapıları olarak da temsil edilebilir. Buradaki örneklerde iki yapıdan hangisinin gösterildiğini söyleyebilir misiniz?
CH3CH(CH3)CH2CH3
Organik yapılarda ortak bağlanma şekilleri
Yapısal formüller çizmek, acemi bir organik kimyager için iyi bir başlangıç noktasıdır ve küçük, basit yapılarla uğraşırken işe yarar. Ancak daha büyük yapılarla uğraşmaya başladığınızda, giderek daha zor ve zaman alıcı hale gelir. Aşağıdaki yapıyı tartışmak istediğinizde her seferinde tüm atomları çizmeye ve bağ kurmaya çalıştığınızı hayal edin, bu da küçük bir DNA parçasıdır:
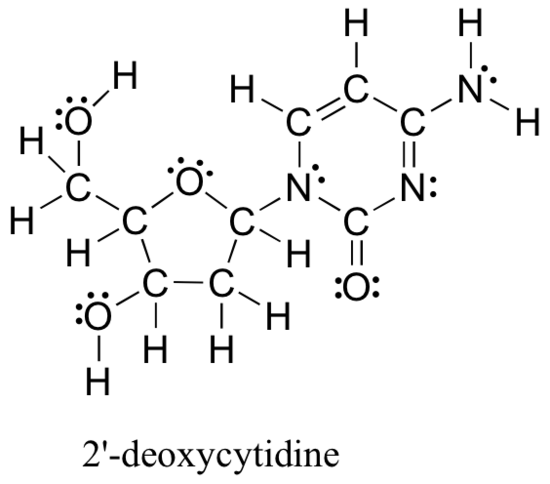
Bunun gibi büyük moleküller genellikle organik kimya ve biyokimyada kabul edilir. Bu durumlarda, Hat bağı yapıları gerçekten yardımcı olur. Onları doğru bir şekilde çizmede iyi olmak için, önce organik moleküllerde sıklıkla bulunan elementleri içeren bazı yaygın bağlanma düzenlemelerine aşina olmak isteyeceksiniz.
Karbon ile başlayalım. Karbonun dört değerlikli olduğu söylenir, yani dört bağ oluşturma eğilimindedir. Karbon da dahil olmak üzere çeşitli yapılara bakarsanız, neredeyse her zaman her karbon atomunun, her biri onu çevreleyen bir çizgi olarak temsil edilen dört bağ elektron çiftine sahip olduğunu görebilirsiniz.
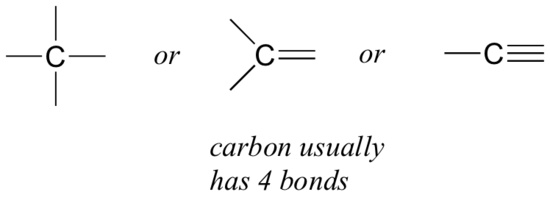
Bu, göreceğimiz organik moleküllerin çoğunda geçerli olan bir modeldir.
Bir karbonun değerlik kabuğunda başka elektron düzenlemeleri varsa ( başka bir deyişle, oktet kuralını yerine getirmiyorsa ), resmi bir yüke sahip olacak veya bir radikal olarak var olacaktır:
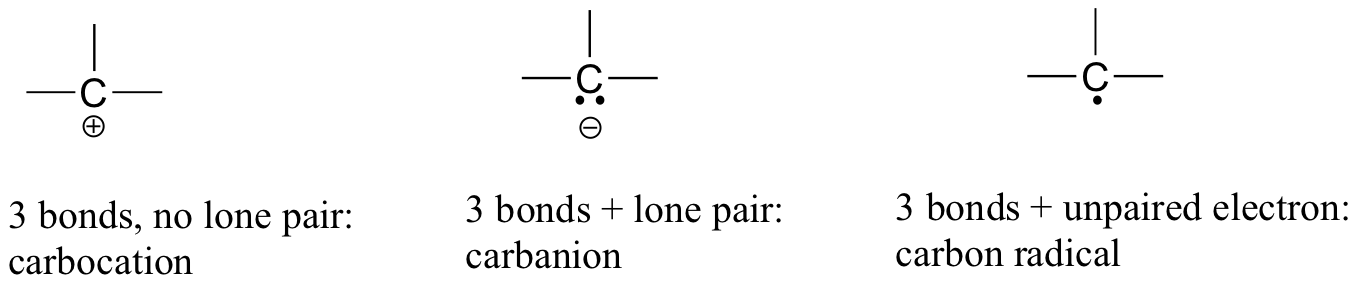
Bu kalıpları ( ve aşağıda diğer atomlar için açıklanan kalıpları ) hızlı bir şekilde tanıyabilirseniz, organik kimya hakkında daha fazla bilgi edinirken size çok yardımcı olacaktır.
Hidrojenler için model kolaydır: hidrojen atomlarının yalnızca bir bağı vardır ve resmi bir yükü yoktur. Kural olarak, organik moleküllerdeki tüm hidrojen atomlarının bir bağı vardır ve resmi bir yükü yoktur.
Oksijen için, hepsi oktet kuralını yerine getiren üç şekilde atom bağı göreceksiniz.
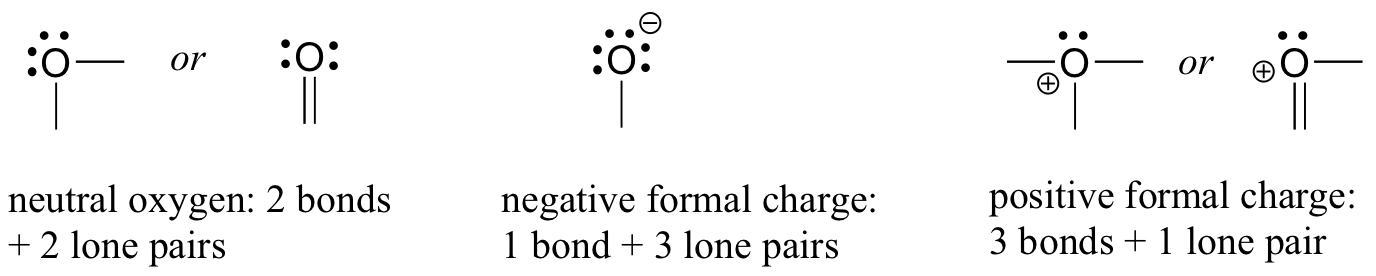
Çoğu durumda, bir oksijen atomunun, suda olduğu gibi iki bağı ve iki yalnız çifti vardır. Bu düzenlemede, resmi bir yükü sıfır olacaktır. Hidroksit iyonunda olduğu gibi bir bağı ve üç yalnız çifti varsa, resmi yükü -1 olacaktır. Üç bağı ve bir yalnız çifti varsa+1'lik resmi bir yüke sahip olacaktır.
Yine, bazı ek olasılıklar var. Bununla birlikte, bu üç örnek, gördüğümüz hemen hemen her şeyi açıklayacaktır.
Azotun, her ikisi de oktet kuralını yerine getiren iki ana bağlanma modeli vardır:
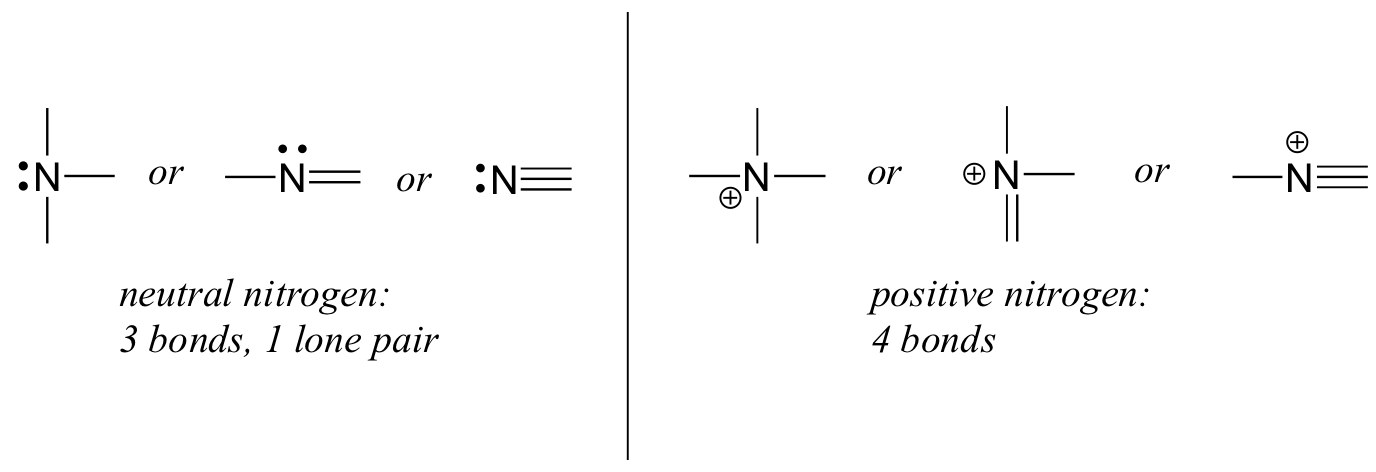
Bir nitrojenin üç bağı ve yalnız bir çifti varsa, resmi yükü sıfırdır. Dört bağı varsa ( ve yalnız bir çifti yoksa ), resmi yükü +1'dir. Oldukça nadir görülen bir bağlanma modelinde, negatif yüklü nitrojenin iki bağı ve iki yalnız çifti vardır.
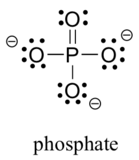
İki üçüncü sıra element, önemli organik moleküllerde yaygın olarak bulunur: kükürt ve fosfor. Bu elementlerin her ikisi de laboratuvar kimyası ile ilgili başka bağlanma modellerine sahip olsa da, biyolojik bağlamda kükürt hemen hemen her zaman oksijen ile aynı bağ/resmi yük modelini takip ederken, fosfor fosfat iyonu ( PO43- ), burada beş bağı ( neredeyse her zaman oksijene ), yalnız çifti yoktur ve resmi yükü sıfırdır. Periyodik tabloda üçüncü satırda ve altında yer alan elementlerin atomlarının, bağlanma için mevcut d orbitalleri ile 'genişletilmiş değerlik kabuklarına' sahip olduğunu ve oktet kuralının her zaman geçerli olmadığını unutmayın.
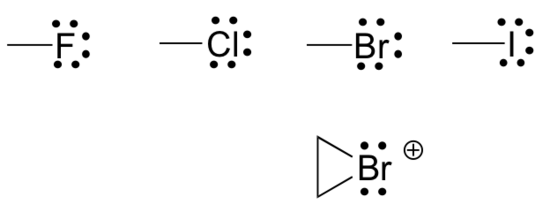
Son olarak, halojenler ( flor, klor, brom ve iyot ) laboratuvar ve tıbbi organik kimyada çok önemlidir, ancak doğal olarak oluşan organik moleküllerde daha az yaygındır. Organik bileşiklerdeki halojenler genellikle bir bağ, üç yalnız çift ve sıfır resmi yük ile görülür. Bazen, özellikle brom söz konusu olduğunda, halojenin iki bağa ( genellikle üç üyeli bir halkada ), iki yalnız çifte ve +1'lik resmi bir yüke sahip olduğu reaktif türlerle karşılaşacağız.
Bu kurallar, eğer öğrenilir ve içselleştirilirse, onlar hakkında düşünmenize bile gerek kalmazsa, oldukça hızlı bir şekilde resmi yüklerle tamamlanmış büyük organik yapılar çizmenize izin verecektir.
Organik yapı türleri genellikle yalnız çiftleri içermez, çünkü her atomun etrafında belirtilen resmi yüke ( veya eksikliğine ) uyması için uygun sayıda elektron bulunduğunu varsayabilirsiniz. Bununla birlikte, bazen, bir açıklamayı daha net hale getirmeye yardımcı oluyorsa, yalnız çiftler çizilir.
'Çizgi bağ yapısı' konvansiyonunu kullanma
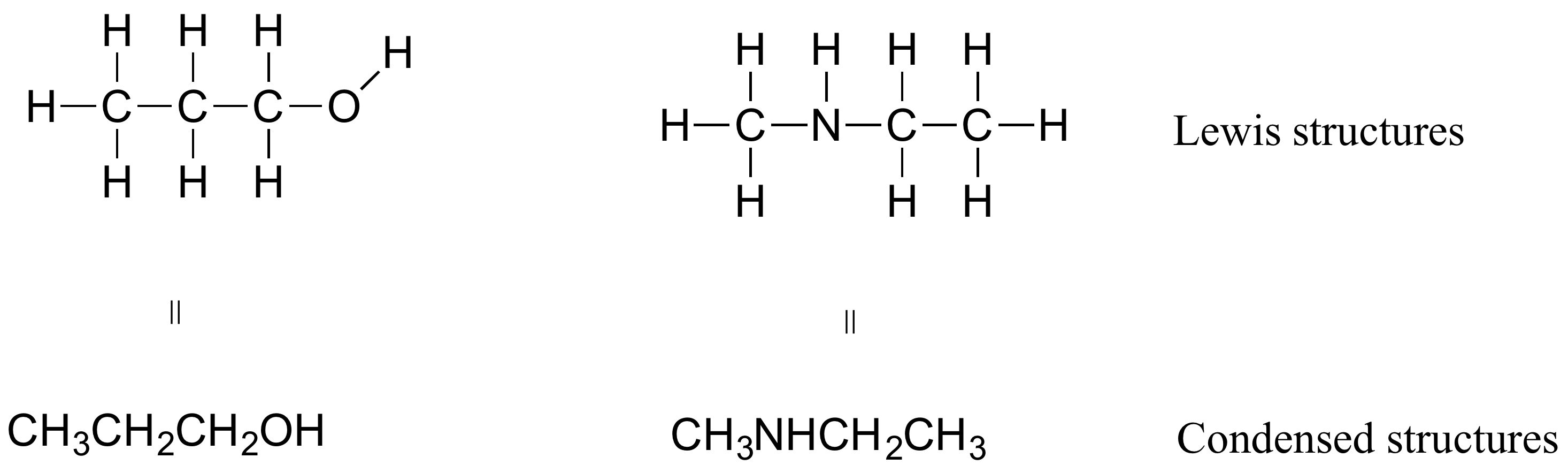
Bu ve diğer kitaplarda organik bileşiklerin nasıl çizildiğine bakarsanız, rakamların genel kimya kitabınızda görmeye alışkın olduğunuz Lewis yapılarından biraz farklı olduğunu göreceksiniz. Bazı kaynaklarda, her bağı içeren tam yapısal formüller yerine daha küçük moleküller için yoğunlaştırılmış yapılar göreceksiniz:
Daha yaygın olarak, organik ve biyolojik kimyagerler, bazen iskelet yapıları olarak da adlandırılan çizgi-bağ yapıları adı verilen kısaltılmış bir çizim kuralı kullanırlar. Konvansiyon, molekülleri çizmeyi kolaylaştırır, ancak konvansiyonun öğrenilmesi gerekir.
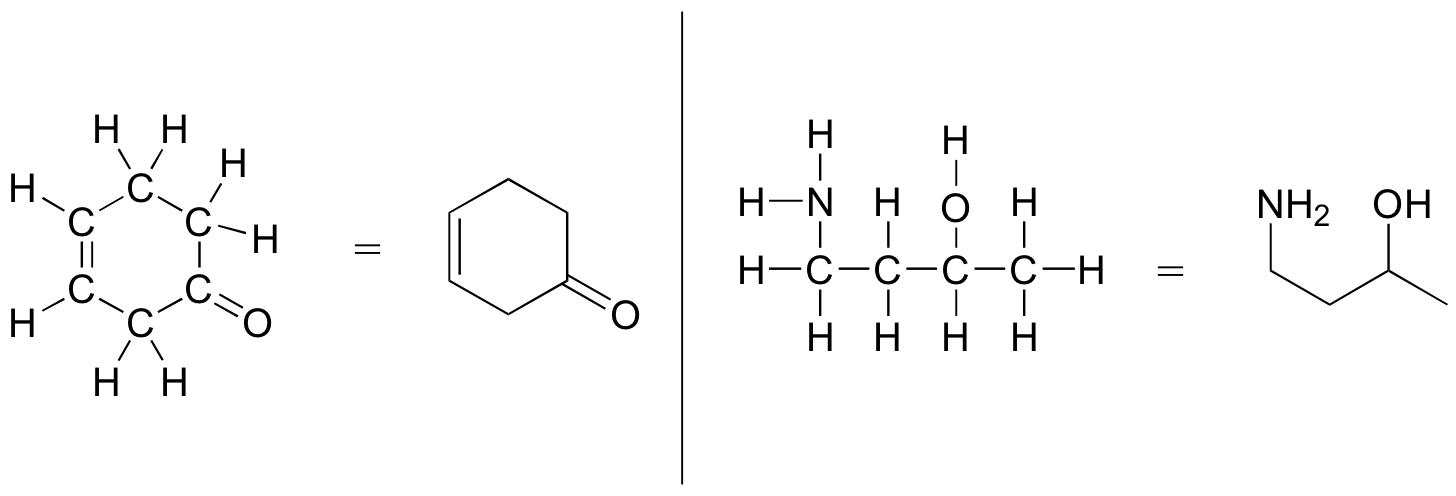
İşte temel olarak nasıl çalışır: Karbon atomları temel sembolleriyle değil, daha ziyade bir tepe noktası ( köşe ) veya bir bağın serbest ucu ile tasvir edilir. Açık zincirli moleküller genellikle 'zig-zig' şeklinde çizilir. Karbonlara bağlı hidrojenler genellikle gösterilmez: daha ziyade, yalnız çiftler gibi, yapıyı görüntüleyen kişinin nerede olduklarını bildiği varsayılır. Azot, oksijen, kükürt veya karbon dışındaki herhangi bir şeye bağlı hidrojenler gösterilir, ancak genellikle bağ gösterilmeden çekilir. Aşağıdaki örnekler kuralı göstermektedir.
Hat bağı yapıları, molekülün temel yapısını ve C-C ve C-H tekli bağlarından başka bir şeyin olduğu yerleri görmeyi çok daha kolay hale getirir. Ayrıca hızlı bir şekilde çizilebilir.
Bazen, bir çizgi yapısındaki bir veya daha fazla karbon atomu, bir açıklamanın takip edilmesini kolaylaştırırsa, büyük bir C ile gösterilecektir. Bir karbonu C ile etiketlerseniz, o karbon için hidrojenleri de çekmeniz gerekir.