Elektrotlar ve Elektrokimyasal Hücreler
Elektrotlar ve Elektrokimyasal Hücreler
- BİLİM ve TEKNOLOJİ
- Tue, 11 Jun 2024 16:14:11
- Tue, 11 Jun 2024 16:14:11
Elektrokimyasal hücre, kimyasal reaksiyonlardan elektrik enerjisi üretebilen veya kimyasal reaksiyonlara neden olmak için elektrik enerjisi kullanabilen bir cihazdır.
Elektrokimyasal Hücre Nedir?
Elektrokimyasal hücre, içinde meydana gelen kimyasal reaksiyonlardan elektrik enerjisi üretebilen veya kendisine verilen elektrik enerjisini içindeki kimyasal reaksiyonları kolaylaştırmak için kullanabilen bir cihazdır. Bu cihazlar kimyasal enerjiyi elektrik enerjisine dönüştürebilir veya tam tersi. Elektrokimyasal hücrenin yaygın bir örneği, TV uzaktan kumandaları ve saatler gibi birçok elektrikli cihaza güç sağlamak için kullanılan standart 1,5 voltluk bir hücredir.
İçlerinde meydana gelen kimyasal reaksiyonlardan elektrik akımı üretebilen bu tür hücrelere Galvanik hücreler veya Voltaik hücreler denir. Alternatif olarak, içlerinden elektrik akımı geçtiğinde içlerinde kimyasal reaksiyonların oluşmasına neden olan hücrelere elektrolitik hücreler denir.
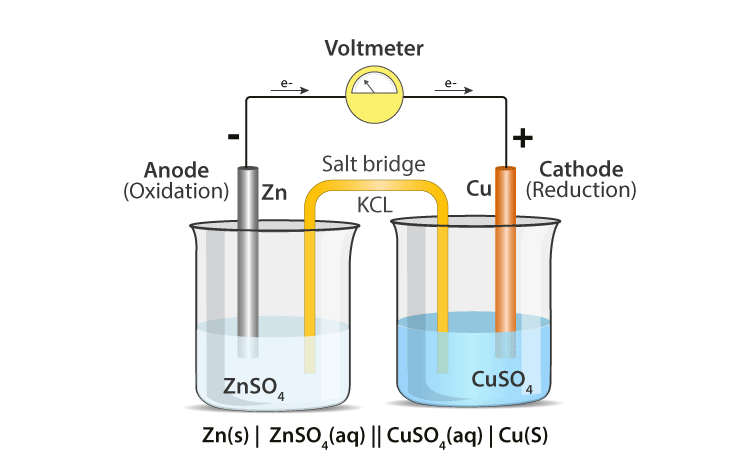
Bir elektrokimyasal hücrenin farklı kısımlarını detaylandıran bir diyagram aşağıda verilmiştir.
Elektrokimyasal hücreler genellikle bir katot ve bir anottan oluşur. Katot ve anotun temel özellikleri aşağıda tablo halinde verilmiştir.
| Katot | Anot |
| Elektronlar burada tüketildiği için pozitif bir işaret ile gösterilir | Elektronlar burada serbest bırakıldığı için negatif bir işaretle gösterilir |
| Bir elektrokimyasal hücrenin katodunda bir indirgeme reaksiyonu meydana gelir | Burada bir oksidasyon reaksiyonu meydana gelir |
| Elektronlar katoda doğru hareket eder | Elektronlar anottan dışarı çıkar |
Genel konvansiyon, katodun sağ tarafta, anotun ise elektrokimyasal bir hücreyi ifade ederken sol tarafta temsil edilmesi gerektiğini belirtir.
Yarım Hücreler ve Hücre Potansiyeli
- Elektrokimyasal Hücreler, her biri bir elektrolite batırılmış bir elektrottan oluşan iki yarım hücreden oluşur. Her iki yarım hücre için de aynı elektrolit kullanılabilir.
- Bu yarım hücreler, birbirleriyle karışmalarına izin vermeden aralarında iyonik temas için platform sağlayan bir tuz köprüsü ile bağlanır. Tuz köprüsüne bir örnek, bir potasyum nitrat veya sodyum klorür çözeltisine batırılmış bir filtre kağıdıdır.
- Elektrokimyasal hücrenin yarım hücrelerinden biri oksidasyon nedeniyle elektron kaybeder ve diğeri indirgeme işleminde elektron kazanır. Her iki yarım hücrede de bir denge reaksiyonunun meydana geldiği ve dengeye ulaşıldığında net voltajın 0 olduğu ve hücrenin elektrik üretmeyi durdurduğu not edilebilir.
- Bir elektrolit ile temas halinde olan bir elektrotun elektron kaybetme veya kazanma eğilimi, elektrot potansiyeli ile tanımlanır. Bu potansiyellerin değerleri, genel hücre potansiyelini tahmin etmek için kullanılabilir. Genel olarak, elektrot potansiyelleri, referans elektrot ( potansiyeli bilinen bir elektrot ) olarak standart hidrojen elektrodu yardımıyla ölçülür.
Birincil ve İkincil Hücreler
- Birincil hücreler temel olarak kullan ve at galvanik hücrelerdir. Bu hücrelerde meydana gelen elektrokimyasal reaksiyonlar doğada geri döndürülemez. Bu nedenle, reaktanlar elektrik enerjisi üretimi için tüketilir ve reaktanlar tamamen tükendiğinde hücre bir elektrik akımı üretmeyi durdurur.
- İkincil hücreler ( şarj edilebilir piller olarak da bilinir ), hücrenin tersinir bir reaksiyona sahip olduğu, yani hücrenin bir Elektrolitik hücrenin yanı sıra bir Galvanik hücre olarak da işlev görebileceği elektrokimyasal hücrelerdir.
- Birincil pillerin çoğu ( seri, paralel veya ikisinin bir kombinasyonu olarak bağlanmış birden fazla hücre ) savurgan ve çevreye zararlı cihazlar olarak kabul edilir. Bunun nedeni, üretim süreçlerinde içerdikleri enerjinin yaklaşık 50 katına ihtiyaç duymalarıdır. Ayrıca birçok toksik metal içerirler ve tehlikeli atık olarak kabul edilirler.
Elektrokimyasal Hücre Çeşitleri
İki ana elektrokimyasal hücre türü şunlardır:
1. Galvanik hücreler ( Voltaik hücreler olarak da bilinir )
2. Elektrolitik hücreler
Galvanik hücreler ve elektrolitik hücreler arasındaki temel farklar aşağıda tablo halinde verilmiştir.
| Galvanik Hücre / Voltaik Hücre | Elektrolitik Hücre |
| Kimyasal enerji, bu elektrokimyasal hücrelerde elektrik enerjisine dönüştürülür. | Elektrik enerjisi bu hücrelerde kimyasal enerjiye dönüştürülür. |
| Bu hücrelerde meydana gelen redoks reaksiyonları doğada kendiliğindendir. | Bu hücrelerde redoks reaksiyonlarının ilerlemesi için bir enerji girişi gereklidir, yani reaksiyonlar kendiliğinden değildir. |
| Bu elektrokimyasal hücrelerde anot negatif, katot ise pozitif yüklüdür. | Bu hücreler pozitif yüklü bir anot ve negatif yüklü bir katoda sahiptir. |
| Elektronlar, oksidasyona uğrayan türlerden kaynaklanır. | Elektronlar harici bir kaynaktan ( pil gibi ) kaynaklanır. |
Elektrokimyasal Hücrelerin Uygulamaları
- Elektrolitik hücreler, birçok demir dışı metalin elektrorafinasyonunda kullanılır. Ayrıca bu metallerin elektrolizinde de kullanılırlar.
- Yüksek saflıkta kurşun, çinko, alüminyum ve bakır üretimi, elektrolitik hücrelerin kullanımını içerir.
- Metalik sodyum, erimiş sodyum klorürden bir elektrolitik hücreye yerleştirilerek ve içinden bir elektrik akımı geçirilerek ekstrakte edilebilir.
- Ticari açıdan önemli birçok pil ( kurşun asitli pil gibi ) Galvanik hücrelerden oluşur.
- Yakıt hücreleri, birkaç uzak yerde temiz enerji kaynağı olarak hizmet veren önemli bir elektrokimyasal hücre sınıfıdır.
Elektrokimyasal Hücreler Hakkında Sıkça Sorulan Sorular
1. Bir Elektrokimyasal Hücrede Tuz Köprüsünün İşlevi Nedir?
Tuz köprüsü, bir elektrokimyasal hücrenin devresini tamamlar ve böylece içinden akım akışına izin verir. Ayrıca hücrenin genel elektriksel nötrlüğünün korunmasına yardımcı olur.
2. Standart Elektrot Potansiyeli Nedir?
Bir elektrotun standart elektrot potansiyeli, standart koşullar altında elektrot ve elektrolit arasında ortaya çıkan potansiyel fark olarak tanımlanabilir ( Sıcaklık = 298K, basınç = 1 atm, reaksiyona giren türlerin birlik konsantrasyonu ). 'Eo cell' sembolü ile gösterilir.
3. Katot ve Anot Arasındaki Temel Farklar Nelerdir?
Bir elektrokimyasal hücrenin katodu, indirgemenin meydana geldiği bölgedir. Genellikle pozitif (+) işareti ile temsil edilir. Elektronlar anottan katoda doğru akar. Elektrokimyasal hücrelerde anot, oksidasyonun meydana geldiği elektrottur. Negatif (-) işareti ile gösterilir.
4. Bir Elektrokimyasal Hücrenin Pozitif Yüklü Bir Anota veya Negatif Yüklü Bir Katoda Sahip Olması Mümkün müdür?
Evet, bir elektrolitik hücrenin anodu pozitif yüklüdür ( ve katot negatif yüklüdür ). Bununla birlikte, negatif yüke rağmen anotta oksidasyon hala meydana gelir. Bu elektrokimyasal hücrelerde meydana gelen kimyasal reaksiyonlar doğada kendiliğinden değildir.
5. Elektrolitik hücreler nedir?
Elektrolitik hücreler, hücre reaksiyonunu kolaylaştırmak için elektrik akımları kullanan bir elektrokimyasal hücre sınıfıdır. Bu tür hücrelerin içinde meydana gelen kimyasal reaksiyona genellikle elektroliz denir. Elektrolitik hücreler, boksiti alüminyum ve diğer bileşenlere parçalamak için kullanılabilir. Bu tür hücreler, suyun hidrojen ve oksijene elektrolizi için de kullanılabilir.