İndirgenme - Yükseltgenme Tepkimelerinde Elektrik Akımı
İndirgenme - Yükseltgenme Tepkimelerinde Elektrik Akımı
- BİLİM ve TEKNOLOJİ
- Tue, 4 Jun 2024 16:05:21
- Tue, 4 Jun 2024 16:05:21
Redoks Reaksiyonu Tanımı
Redoks reaksiyonları nelerdir?
Bu, kimya ve biyolojide yaygın bir terimdir. Kimyada redoks reaksiyonu, atomların oksidasyon durumlarındaki değişikliği içeren kimyasal reaksiyon türlerinden biridir. Bu reaksiyonda, farklı kimyasal türler arasında gerçekleşen elektronların gerçek transferi veya kayması vardır. Bu reaksiyonda bir tür elektron kaybederken diğeri elektron kazanır. Elektron kazanan türlerin azaldığı, elektron kaybeden türlerin ise oksitlendiği söylenir. Biyolojide, bir redoks reaksiyonu, çok çeşitli biyolojik süreçlerde meydana gelen reaksiyon şekli olduğu için yaşamın tüm yönlerini tanımlamıştır.
Redoks reaksiyonlarında neler yer alır?
Redoks reaksiyonu kuralına göre, reaksiyon iki bölümden oluşur ve her zaman birlikte gerçekleşir. Bunlar indirgenmiş yarısı ve oksitlenmiş yarısıdır. İndirgeme yarısı ve oksidasyon yarısı reaksiyonları, redoks reaksiyonlarının iki yarı reaksiyon biçimidir.
Biyoloji tanımı:
Redoks reaksiyonu, reaksiyona dahil olan atomların oksidasyon sayılarında değişikliklere neden olan, hem indirgeme hem de oksidasyonu içeren kimyasal bir reaksiyondur. Oksidasyon, oksidasyon sayısında bir artış olduğu zamandır; İndirgeme, oksidasyon sayısında bir azalma olduğu zamandır. Hücresel solunum ve fotosentez gibi birçok önemli biyolojik süreçte yer alır. Örneğin hücresel solunumda, glikoz karbondioksite oksitlenirken oksijen suya indirgendiğinde redoks reaksiyonu meydana gelir. Varyant: oksidasyon-indirgeme reaksiyonu.
Redoks reaksiyonu nasıl belirlenir?
Redoks reaksiyonu her zaman iki atomun oksidasyon durumundaki bir değişiklikle belirlenir. Oksidasyon sayısında herhangi bir değişiklik yoksa redoks reaksiyonu da olmaz. Redoks reaksiyonunun bir başka özelliği de iki eşzamanlı süreçten oluşmasıdır, dolayısıyla adı. Bunu daha iyi anlamak için oksidasyon ve indirgeme tanımlarını anlayalım.
Oksidasyon nedir?
Oksidasyon, bir atomun, iyonun veya molekülün oksidasyon durumunu artırma işlemidir. Basitçe söylemek gerekirse, elektronu kaybetmek anlamına gelir.
Redüksiyon nedir?
İndirgeme, bir atomun, iyonun veya molekülün oksidasyon durumunu azaltma işlemidir. Ya da sadece elektronun kazanılmasını ifade eder. ( Evet, bu konuda indirgeme "kazanmak" anlamına gelir ). Yani bir redoks reaksiyonunda, biri elektron kaybederken, diğeri onu kazanır.
Redoks Reaksiyonlarının Türleri
Bunlar farklı redoks reaksiyonu türleridir ve her biri aşağıda açıklanmıştır.
- Ayrışma Reaksiyonu
- Kombinasyon Reaksiyonu
- Yer Değiştirme Reaksiyonu
- Orantısızlık Reaksiyonu
1. Ayrışma Reaksiyonu
Adından da anlaşılacağı gibi, ayrışma reaksiyonunda, reaktan farklı bileşenlere bölünür veya kırılır: AB → A + B
Örnekler:
- 2NaH → 2Na + H2
- 2H2O → 2H2 + O2
Yukarıdaki ürünler, reaktantın ayrışmasıyla oluşur. Sonuç olarak, daha küçük kimyasal bileşikler oluşur.
Bununla birlikte, bazı durumlarda, her ayrışma reaksiyonunun aynı zamanda bir redoks reaksiyonu olması gerekmez. Örneğin, CaCO3 → CaO + CO2 bir ayrışma reaksiyonudur, ancak bir redoks reaksiyonu değildir. Bu neden bir redoks reaksiyonu değil? Ayrışma reaksiyonu CaCO3 → CaO + CO2 bileşenlerin ayrışmasını içerir, ancak oksidasyon durumlarında herhangi bir değişiklik olmaz. Redoks reaksiyonu olduğunda değişmesi gereken oksidasyon sayısı değişmedi.
2. Kombinasyon Reaksiyonu
Ayrışma reaksiyonunun tersi bir kombinasyon reaksiyonudur. Bu reaksiyonda, iki reaktanın bir kombinasyonu vardır ve bir ürün oluşur: A + B → AB
Örnekler:
- H2 + Cl2 → 2HClC+O2→CO2
- 4Fe+ 3O2→2Fe2O2
3. Yer Değiştirme Reaksiyonu
Adından da anlaşılacağı gibi, bu reaksiyon, bir iyonun veya bir atomun bir elementten başka bir elementin iyonuna veya atomuna değiştirilmesini içerir: X + YZ → XZ + Y . Yer değiştirme reaksiyonları iki şekildedir. Bunlar metal yer değiştirme reaksiyonları ve metal olmayan yer değiştirme reaksiyonlarıdır.
- Metal Yer Değiştirme: Metal yer değiştirme reaksiyonlarında, genellikle bir metalin yerini başka bir metal alır. Bir örnek CuSO4+Zn→Cu+ZnSO4'dur. Metal yer değiştirme reaksiyonları, metalurjik işlemde cevherlerinden saf metaller elde etmek için kullanılır.
- Metal Olmayan Yer Değiştirme: Metal olmayan bir yer değiştirme reaksiyonunda, yer değiştirme için hidrojen H2'dir veya bazen oksijen O2'dir kullanılır.
4. Orantısızlık Reaksiyonu
Bir orantısızlık reaksiyonunda, tek bir reaktan oksitleyici olmanın yanı sıra indirgeyicidir.
Örnek:
P4 + 3NaOH + 3H2O → 3NaH2PO2 + PH3
Oksitleyici ve İndirgeyici Ajanlar
Redoks reaksiyonlarında iki tür kimyasal ajan vardır. Bunlar oksitleyici ajanlar ( oksitleyiciler ) ve indirgeyici ajanlardır ( indirgeyiciler ). Oksidasyon ve indirgeme süreçlerindeki rollerini anlayarak onları ayırt edelim.
Tablo 1: Oksidasyon ve İndirgeme |
|
|---|---|
| Oksitlenme | Azaltma |
| Oksidasyonda elektron "kaybolur" | İndirgemede elektron "kazanılır" |
| Reaktanların artan oksidasyon durumu | Reaktanların oksidasyon durumunun azalması |
| Elektron veren ve oksidasyona uğrayan bir tür, indirgeyici ajan olarak bilinir. Bu nedenle "elektron donörü" olarak da adlandırılır. Bir elektron kaybettiğinde, böylece "oksitlenir". | Elektronu kabul eden veya bir atomu indirgeyen bir türe oksitleyici ajan denir. Bu nedenle "elektron alıcısı" olarak da bilinir. Bir elektronu kabul ettiğinde, böylece "indirgenir". |
| İndirgeyici ajanlara örnek olarak sodyum, magnezyum ve demir gibi elektropozitif elementler verilebilir | Oksitleyici ajanların örnekleri, aşağıdakiler gibi elektronegatif elementlerdir: O2 ve F2 |
Standart Elektrot Potansiyeli
Standart Elektrot Potansiyeli, hidrojen moleküllerinin ( H2 ) standart basınç altında çözünmüş protonlar şeklinde oksitlenir.
Elektrokimyasal hücredeki redoks reaksiyonlarının amacı nedir?
Redoks reaksiyonu, bir elektrokimyasal hücrenin temelidir. Anotta oksidasyon ve katotta indirgeme olmak üzere iki yarı reaksiyona ayrılabilir. İki elektrotun elektrik potansiyeli arasındaki farktan dolayı elektrik üretilir. Ve iki metal elektrotun potansiyelleri arasındaki fark nedeniyle, elektrolit için potansiyelde bir fark yaratılır. Herhangi bir elementin veya bileşiğin indirgeme gücünü ölçmek için kullanılır.
Tek başına elektrot potansiyelini veya elektrolit potansiyelini doğru bir şekilde ölçmek için kullanılan basit ve kolay bir yol yoktur. Basınç, sıcaklık veya konsantrasyondaki değişiklikler sadece elektrik potansiyelini değil, aynı zamanda elektrokimya denklemlerini de etkiler. Bir redoks reaksiyonunda, oksidasyon potansiyeli, indirgeme potansiyelinin negatifidir, bu nedenle potansiyellerden birini hesaplamak yeterlidir. Standart elektrot potansiyelinin aynı zamanda standart indirgeme potansiyeli olarak da yazılmasının nedeni budur.
Standart indirgeme potansiyelinin değeri daha büyükse, indirgeme ( elektron kazanımı ) daha kolay hale gelir. Örneğin, F2'nin standart indirgeme potansiyeli +2.87V'dir ve daha sonra Li için -3.05V'dir.+
Peki ya biyoloji? Biyolojik hücredeki redoks reaksiyonlarının amacı nedir?
Biyolojik bir hücrede, metabolizma sırasında şeker molekülünün suya, karbondioksit gazına ve enerjiye parçalanması gibi redoks reaksiyonlarının farklı amaçları vardır. Şekerdeki karbon atomundan oksijene enerji salınımı ile birlikte 48 elektronun transferi söz konusudur.
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l) + enerji
Canlı vücudundaki redoks reaksiyonlarının bir başka amacı da hücresel iletişimdir. Hücrede oksijen içeren reaktif moleküller sinyal molekülleri olarak rol oynarlar. Örneğin, oksijen içeren reaktif moleküller ( O2, H2O2, NO ) redoks reaksiyonları sırasında hücrede kontrollü bir şekilde üretilir. Bu kimyasalların yara iyileşmesi, iltihaplanma, yaşlanma ve programlanmış hücre ölümü gibi farklı rolleri vardır.
Daha yeni çalışmalara göre, redoks reaksiyonu hücrelerde kanser tedavileri için de kullanılabilir. Bir sınıf kanser tedavisi ilacı, tümör gövdesinde oksijen içeren reaktif moleküllerin üretimini arttırır ve bu da sonunda kanser hücrelerini öldürür.
Redoks Reaksiyonlarına Örnekler
Redoks reaksiyonlarının bazı örnekleri aşağıdaki gibidir.
Örnek 1: Hidrojen ve Flor Arasındaki Reaksiyon
Flor ve hidrojenin reaksiyonunda hidrojende oksidasyon gerçekleşirken, florda indirgeme meydana gelir. Hidrojen ve flor birleşerek Hidrojen Florür oluşturur.
Aşağıdaki denklem reaksiyonu gösterir: H2 + F2 → 2HF
Oksidasyon denklemi H2 → 2H + 2e+–
İndirgeme denklemi F2 + 2e– → 2F–
Örnek 2: Demir ve Hidrojen Peroksit Arasındaki Reaksiyon
Hidrojen peroksit demir iyonunu oksitler Fe2+ ferrik iyona Fe3+ bir asit varlığında. Sonuç olarak, bir hidroksit iyonu oluşur. Hidrojen peroksit, su oluşumu için asit tarafından bağışlanan bir proton ile reaksiyona girer.
2Fe22+ + H2O2 + 2H + → 2Fe3+ + 2H2O
Oksidasyon yarı reaksiyonu Fe2+ → Fe3+ + e–
İndirgeme yarı reaksiyonu H2O2 + 2e– → 2OH–
Örnek 3: Çinko ve Bakır Arasındaki Reaksiyon
Zn, bakır sülfat çözeltisindeki bakır iyonunun yerini aldığında, bakır metali kazanılır.
Zn (s) + CuSO4 (aq) → ZnSO4 (aq) + Cu (s)
Oksidasyon yarı reaksiyonu Zn → Zn2+ + 2e–
İndirgeme yarı reaksiyonu Cu2+ + 2e– → Cu
Redoks Reaksiyonlarının Önemi
Oksidasyon - indirgenme reaksiyonları, doğal ( biyolojik ) veya doğal olmayan ( yapay ) yollarla Dünya'daki en önde gelen ve başlıca enerji kaynağı oldukları için önemlidir. Bir oksidasyon reaksiyonunda ya hidrojenin uzaklaştırılması ya da oksijen kombinasyonu ile büyük miktarda enerji elde edilebilir.
Endüstride Redoks Reaksiyonları
Klor, kostik soda vb. endüstrilerde yaygın olarak kullanılan birçok kimyasal, redoks reaksiyonları ile oluşur. Redoks reaksiyonları, ağartma malzemesinde ve su sterilizasyonunda kullanılır. Endüstriyel temizlik ürünlerinin imalatında oksidasyon işlemi kullanılmaktadır. Korozyon riski taşıyan birçok metal, kurban anotlarla birleştirilerek korunur. Çeliğin galvanizlenmesi buna bir örnektir. Amonyağın oksidasyonu, esansiyel bir gübre olan nitrik asit üretti. Redoks reaksiyonu, metallerin cevherlerinden ayrılması için de kullanılır. Bir indirgeyici ajanın varlığında metal sülfürün eritilmesi de buna bir örnektir. Altın kaplama süs eşyalarının imalatında, nesnenin yüzeyine ince bir kat malzeme uygulamak için bir redoks reaksiyonu kullanılır. Bu işlem aynı zamanda elektrokaplama olarak da bilinir.
Biyolojide Redoks Reaksiyonları
Hücredeki redoks reaksiyonlarının amacı nedir? Birçok biyolojik süreç, hücresel solunum ve fotosentez gibi redoks reaksiyonlarını içerir.
Hücresel solunum
Hücresel solunum ( C6H12O6 + 6 O2 → 6 CO2 + 6 H2O ), glikozun karbondioksite ( CO2 ) ve oksijenin azaltılması ( O2 ) suya ( H2O )Hücresel solunum redoks yöntemi, NAD'nin NADH'ye indirgenmesi ve oksidasyonu ile ilgilidir ve bunun tersi de geçerlidir. Aşağıda hücresel solunumun şematik bir diyagramı bulunmaktadır.+
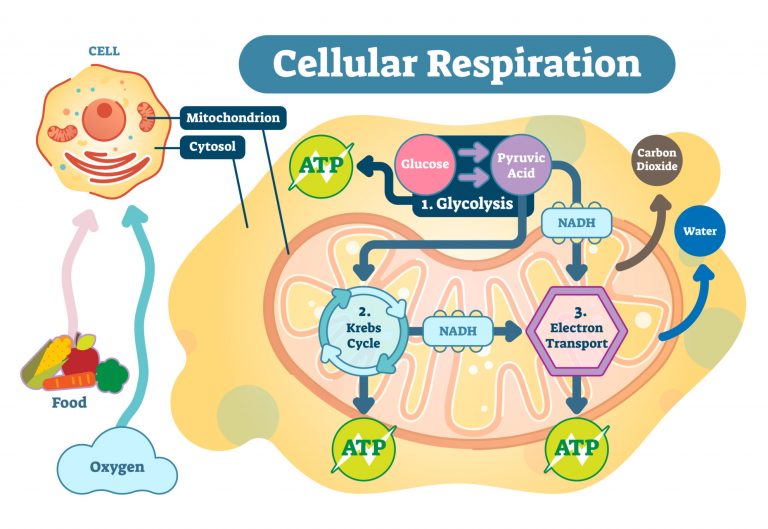
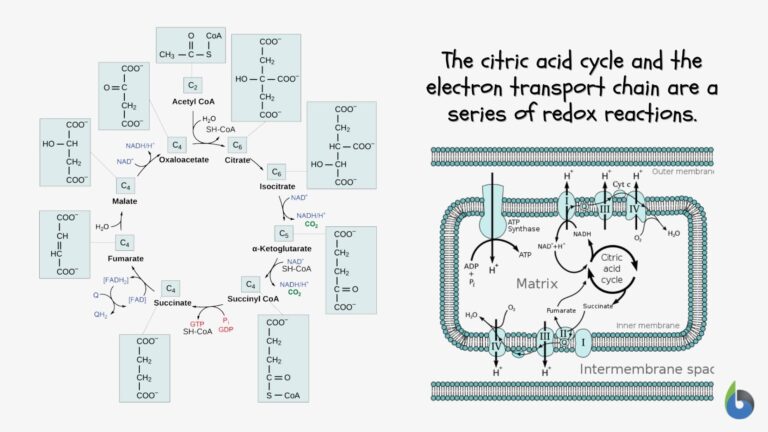
Fotosentez
Fotosentezde redoks reaksiyonlarında ( 6 CO2 + 6 H2O + ışık enerjisi → C6H12O6 + 6 O2 ), Karbondioksit şekere indirgenir ve su oksidasyonu moleküler oksijen verir. Oksijendeki elektron sayısı 8'dir. Hücresel solunum ve fotosentez zıt reaksiyonlar gibi görünse de, bu iki süreç birbirinin tersi değildir.
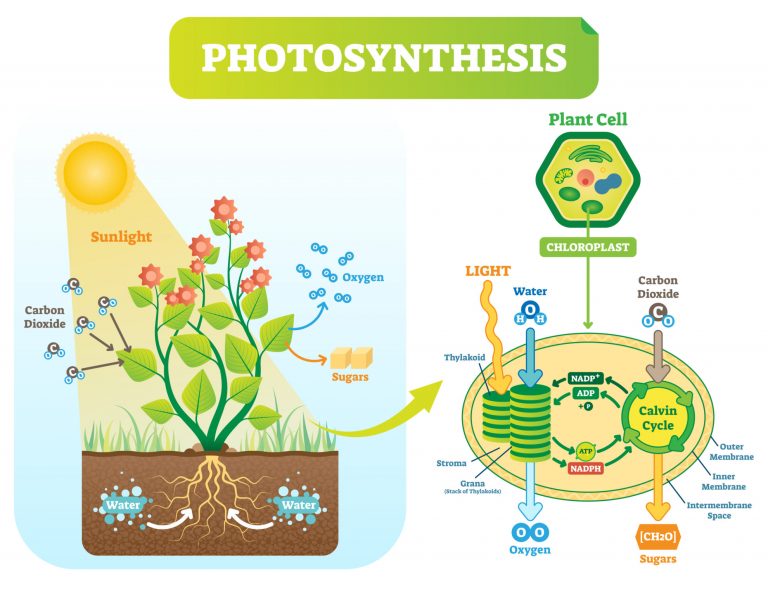
Redoks Döngüsü
Serbest radikallerin oluşumu için enzimlerin yardımıyla çok çeşitli aromatik bileşikler azaltılır. Serbest radikallerin ebeveynlerinden bir veya daha fazla elektronu vardır. Elektron donörü herhangi bir flavoenzim veya koenzimi olabilir. Oluşumdan bir sonra, anyon formundaki serbest radikaller oksijeni süperokside indirgedi ve ayrıca etkilenmemiş ana ( orijinal ) bileşik yenilendi. Genel olarak, bu reaksiyonda, süperoksit oluşumu için flavoenzim koenziminde oksidasyon ve moleküler oksijende azalma vardır. Bu katalitik davranışa Redoks Döngüsü denir.
Jeolojide Redoks Reaksiyonları
Jeolojide redoks reaksiyonunun aşağıdakiler gibi birçok kullanımı vardır:
- Minerallerin mobilizasyonu
- Minerallerin oluşumu
- Çökelme ortamları
Kayaların renginde redoks durumu görülebilir. Oksitleyici kaya kırmızı bir renge sahipti. Kayaya indirgeyici bir sıvı veya sıvı geçirildiğinde yeşil veya beyaz renk verir. İndirgeyici sıvı veya sıvı, uranyum içeren minerallere sahipti. Moqui mermerleri ve uranyum yatakları, jeolojik redoks reaksiyonlarından oluşan bazı tortu örnekleridir.
Topraklarda Redoks Reaksiyonları
Bir redoks reaksiyonunda, aynı anda oksidasyon ve indirgeme reaksiyonu vardır. Topraktaki redoks reaksiyonunun bir örneği, su varlığında oksijenin indirgenmesiyle demirin ferrik demire oksidasyonudur.
Redoks Reaksiyonlarının Dengelenmesi
Aşağıda, bir redoks denkleminin nasıl dengeleneceği veya temel çözeltilerde redoks reaksiyonlarının veya redoks reaksiyonlarının nasıl yapılacağı açıklanmaktadır.
- Adım I: Dengesiz denklemi yazın.
- Adım II: Redoks reaksiyonunu iki yarı reaksiyona ayırın Her atoma oksidasyon numarası verin Redoks çiftlerini bulun ve yazın Redoks çiftlerini iki yarı reaksiyonda birleştirin
- Adım III: Yarı reaksiyonların dengelenmesi H2 hariç tüm atomları dengeleyin ve O2 Tüm O2'ları dengeleyin su H2O ile atomlar Hidrojen atomlarını H ile dengeleyin 1 OH+– ekleyin temel bir ortam için H'nin her iki tarafında+
- Adım IV: Elektron sayısını dengeleyin
- Adım V: Yarı reaksiyonda, elektron kaybını elektron kazancına eşit yapın
- Adım VI: Birlikte yarım reaksiyonlar ekleyin
- Adım VII: Denklemi basitleştirin
Sonunda tüm yüklerin ve elemanların dengelendiğini kontrol edin. Kolaylık sağlamak için, denklem dengeleme için çevrimiçi bir redoks reaksiyonu hesaplayıcısı veya oksidasyon durumu hesaplayıcısı da kullanılır.
Oksidasyon numaraları nasıl bulunur?
Aşağıda bazı oksidasyon sayısı kuralları verilmiştir:
1. Sıfır, serbest elementlerin oksidasyon sayısıdır.
2. Bir iyon üzerindeki yük, tek atomlu iyonların oksidasyon sayısına eşdeğerdir.
3. İyonlar üzerindeki yük, çok atomlu iyonların oksidasyon sayısına da eşdeğerdir.
4. Hidrojenin oksidasyon sayısı +1'dir, ancak bazı elektronegatif elementlere sahip bir bileşikte olduğunda oksidasyon sayısı -1 olarak değişir.
5. Oksijen oksidasyon sayısı -2'dir, ancak peroksitlerde -1'dir.
6. Karbon oksidasyon sayısı büyük ölçüde değişir. CH4'de CO2 içindeyken -4'tür +4'dir.
7. Grup 1 elementin oksidasyon numarası +1'dir.
8. Grup 2 elementinin oksidasyon numarası +2'dir.
9. Grup 17 elementinin oksidasyon numarası -1'dir.
10. Nötr bir bileşikte, tüm atomların toplam oksidasyon sayısı sıfırdır.