Kimya ve Elektrik
Kimya ve Elektrik
- BİLİM ve TEKNOLOJİ
- Tue, 28 May 2024 15:13:22
- Tue, 28 May 2024 15:13:22
Elektroliz, bir bileşiğin elektrikle parçalanması işlemidir. Elektrik akımı, yüklü parçacıkların akışıdır.
Elektroliz konusundaki 1800 yılında Anthony Carlisle ve William Nicholson, 1807 yılında Humphry Davy ve 1833 yılında Faraday'ın keşifleri ve, 1887 yılında Svante Arrhenius tarafından geliştirilen iyon teorisi, zamanımızın atom fiziğine temel teşkil etmişlerdir.
İletkenlik:
Katılarda elektriği ileten maddelere İletken denir. Bunlar çoğunlukla metaller ve grafittir. Bunun nedeni, metallerin ve grafitin yapılarında yükü taşımak için serbest elektronlar içermesidir. Elektriği iletmeyen katı maddelere İzolatör denir.
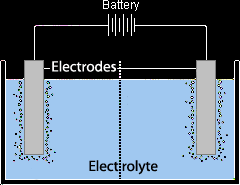
Bir katıyı elektriksel iletkenlik açısından test etmek için, ona yukarıdaki gibi bir elektrik devresi koyarız. Ampul yanarsa veya ampermetre bir okuma verirse, katı bir iletkendir.
Ancak sıvılar için elektriği iletenlere elektrolit denir. Olmayanlara elektrolit olmayanlar denir. Elektrolitler, erimiş veya sulu formda asitleri, alkalileri ve iyonik bileşikleri içerir.
Elektroliz Hücresi:
Elektroliz hücresi, her bir kutbu bir elektroda bağlı bir pildir ve her iki elektrot da elektrolize edilecek sıvıya batırılır.
- Pozitif kutba bağlı elektroda anot denir.
- Negatif kutba bağlanan elektroda katot denir.
Aktif elektrotlar ve inert elektrotlar olmak üzere iki tip elektrot vardır. Aktif elektrotlar kendi kendine işlemde yer alır. İnert elektrotlar, akımı müdahale etmeden iletmek için oradadır.
İnert elektrotlar grafit veya platin olabilir, ancak grafit daha ucuz olduğu için daha yaygın olarak kullanılır.
İnert elektrotlar her zaman elektrolizde kullanılır; Elektrokaplamada aktif olanlar kullanılır.
Nasıl Çalışır:
Elektroliz, iyonik bir bileşiği onu oluşturan elementlere ayırır. Örneğin, elektroliz yoluyla sodyum klorürden sodyum ve klor elde edebiliriz.
Akım açıldığında, elektrolitteki negatif iyon, zıt yüklü oldukları için pozitif elektrota çekilir. Bu gerçekleştiğinde negatif iyon, bağ oluşumu sırasında pozitif iyondan aldığı elektronları kaybeder ve bir atom haline gelir. Kaybedilen elektronlar, dış devredeki tel vasıtasıyla anottan katoda aktarılır. Aynı zamanda, elektrolitten gelen pozitif iyon, negatif iyon tarafından kaybedilen elektronları kazandığı ve aynı zamanda bir atom haline geldiği katoda çekilir.
İyonik bileşiklerde pozitif iyon bir metaldir ve katotta toplanır. Ve negatif iyon metal değildir ve anotta toplanır.
Elektronlar, teller aracılığıyla anottan katoda aktarılır.
Elektrolit, erimiş veya sulu formda iyonik bir bileşiktir. İyonik bileşikler elektriği yalnızca bu formlardayken iletirler çünkü akımı taşıyabilen serbest hareketli iyonlar içerirler, ancak katı halde değildirler.
Erimiş İyonik Bileşiklerin Elektrolizi:
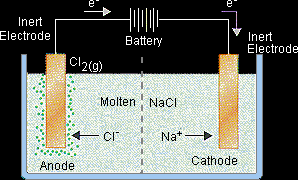
Sodyum klorürün elektrolizi için idealize edilmiş bir hücre yukarıdaki şekilde gösterilmiştir. Bir doğru akım kaynağı erimiş sodyuma batırılmış bir çift inert elektrota bağlı Klorür. Tuz eriyene kadar ısıtıldığından, Na+ iyonları negatif elektrota doğru akar ve Cl- iyonları pozitif elektrota doğru akar.
Negatif elektrot ( katot ): Na+ + e- → Na
Pozitif elektrotla çarpışan Cl- iyonları Cl2 gazına oksitlenir, bu sırada köpürür elektrot.
Pozitif elektrot ( anot ): 2Cl- → Cl2 + 2e-
Bir elektrik akımını geçirmenin net etkisi Bu hücredeki erimiş tuz, sodyum klorürü kendi içine ayrıştırmaktır. Elementler, sodyum metali ve klor gazı.
2NaCl(l) → 2 Na(l) + Cl2(g)
Bu örnek işlemin neden elektroliz olarak adlandırıldığını açıklamaktadır. Elektroliz -lysis son eki Yunanca gevşetmek veya ayırmak kökünden gelmektedir. Elektroliz kelimenin tam anlamıyla bir bileşiği elementlerine ayırmak için bir elektrik akımı kullanır.
Sulu İyonik Bileşiklerin Elektrolizi:
İyonik bir bileşiğin çözeltisinde elektrolize edilmesi, eridiğinde elektrolize edilmesinden çok farklıdır. Bunun nedeni, bir çözeltide 4 iyon, H+ ve OH- sudan ve bileşikten bir pozitif ve bir negatif iyona sahip olmamızdır. Ancak her elektrotta yalnızca bir tür iyon boşaltılır.
Pozitif iyonlar için katotta boşalan en az reaktif olanıdır. Bunun nedeni, en az reaktif elementlerin atom olma eğiliminin daha fazla olmasıdır.
Yani iyonik bileşikten gelen iyon, reaktivite serisinde ( daha reaktif ) hidrojenin üzerindeyse, H+ anotta boşalır Ve bileşikten gelen iyon, reaktivite serisinde hidrojenin altındaysa ( daha az reaktif ), bu iyon katotta boşalır.
Örneğin, sulu sodyum klorürü elektrolize ediyorsak, sodyum hidrojenden daha reaktif olduğu için H+ iyonları katotta boşalacaktır. Ve sulu bakır iyodürü elektrolize ediyorsak, Cu2+ iyonları katotta boşalacaktır çünkü bakır hidrojenden daha az reaktiftir.
Ancak negatif iyonlar için durum farklıdır. OH-'den gelen oksijen, bir durum dışında, her zaman anotta boşaltılır, bu, diğer negatif iyonun bir halojenür olmasıdır. OH-'den oksijen boşaltılırsa, denklem şöyle olacaktır:
4OH- - 4e → O2 + H2O
Diğer negatif iyon bir halojenür ise, iki olasılık vardır:
- OH-'den gelen oksijen katotta boşalır,
- Halojenür iyonu katotta boşaltılır.
Her şey halojenürün konsantrasyonuna bağlıdır. Elektrolit konsantre bir çözelti ise, OH-'den daha fazla halojenür iyonu vardır. Böylece halojenür iyonu katotta boşalır. Elektrolit seyreltik bir çözelti ise, halojenür iyonlarından daha fazla OH- iyonu vardır, bu nedenle OH-'den oksijen boşaltılır.
Örneğin, elektrolit konsantre bir sodyum klorür çözeltisi ise, katotta hidrojen gazı oluşur çünkü hidrojen sodyumdan daha az reaktiftir. Ve çözelti konsantre olduğu için anotta klor gazı oluşur.
Elektrolit seyreltik bir gümüş sülfat çözeltisi ise, hidrojenden daha az reaktif olduğu için katotta gümüş oluşur ve anotta oksijen gazı oluşur.
Tuzlu su elektrolizi ( konsantre sulu sodyum klorür ):
Elektrolitte bulunan iyonlar sudan H+ ve OH- ve sodyum klorürden Na+ ve Cl-'dir.
Sodyum, hidrojenden daha reaktif olduğu için H+ iyonları katotta boşalacak ve hidrojen gazı gelişecektir. Ve çözelti konsantre olduğu için Cl- boşaltılacak ve klor gazı gelişecektir. Ancak klorun suda çözünür olduğunu, gelişmesinin zaman alacağını ve bir miktar oksijenin de oluşabileceğini unutmayın. Gazlar ters çevrilmiş bir ölçüm silindirinde toplanmalıdır.
Bu bizi diğer iki iyonla baş başa bırakır, Na+ ve OH-. Bir alkali olan sodyum hidroksit oluşturarak birbirine bağlanırlar ve daha sonra ekstrakte edilirler.
Katotta: 2H+ + 2e- → H2
Hidrojen gazı gelişir. Gözlem, renksiz gaz kabarcıklarıdır.
Işıklı bir atele yaklaştığınızda, pozitifse bir patlama sesiyle yanacağından emin olmak için test edin.
Anotta: 2Cl- - 2e- → Cl2
Klor gazı gelişir. Gözlem yeşil gaz kabarcıklarıdır. Nemli mavi bir turnusol kağıdına yaklaşarak emin olmak için test edin, pozitifse kırmızıya dönecek ve ardından ağartıcıya dönecektir.
2NaCl +2H2O→H2 +Cl2 + 2NaOH
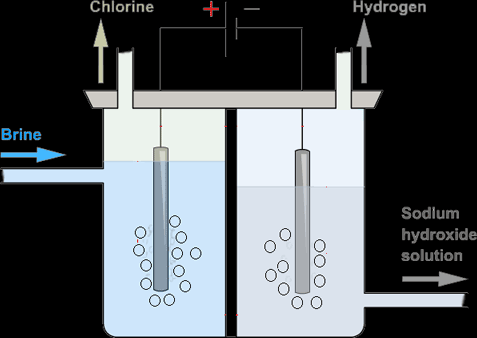
Bir Membran Hücresinde Tuzlu Suyun Elektrolize Edilmesi:
Mümkün olan en saf ürünleri elde etmek için, yukarıdaki gibi bir zar hücresi kullanılır.
Bu hücrede, her iki elektrot arasında Cl- iyonlarını OH- iyonlarından ayıran bir zar vardır. Membrana çözelti eklendiğinde, membran Na+, H+ ve OH- iyonlarının katot odasına geçmesine izin verir ve Cl- anot odasında kalır. OH- katot odasında sıkışıp kalırken Cl- deşarj olur ve toplanan klor gazını kirletemez. H+ anotta boşaltılır ve toplanır. Na+ ve OH- birbirine bağlanarak katot odasının dibinden ekstrakte edilen sodyum hidroksit oluşturur.
Bakır(II) Sülfat Çözeltisinin Elektrolizi:
Elektrolitte bulunan iyonlar sudan H+ ve OH- ve bakır(ii) sülfattan Cu+2 ve S04-'dir.
Katotta: 4OH- - 4e- → O2 + 2H2O.
OH- iyonlarından oksijen oluşur. Renksiz gaz kabarcıkları oluşur. Oksijeni test etmek için, parlayan bir atele yaklaşın, pozitifse yeniden yanar.
Anotta: Cu+2 + 2e- → Cu.
Cu+2 deşarj edilir çünkü bakır hidrojenden daha az reaktiftir. Kırmızı kahverengi bir metal oluşur.
Bu bizi, sülfürik asit oluşturan birbirine bağlanan H+ ve S04- iyonları ile bırakır.
Not: Bir bakır sülfat çözeltisi mavi renktedir. Bu işlemde bakır sülfat parçalandığı için mavi renk yavaş yavaş kaybolur. Çözelti asidik hale gelir, sülfürik asit oluştuğu için asidik hale gelir.
- Not:
- Bir elektroliz ürünü bir halojen olduğunda, suda çözünür olduğunu, bu nedenle evrimleşmesinin zaman alabileceğini ve OH-'den oksijen ile değiştirilebileceğini unutmayın.
- Bir elektroliz ürünü bir halojen olduğunda, halojenler toksik olduğu için bunu bir çeker ocakta gerçekleştirin.
Elektroliz ve Rafinasyon:
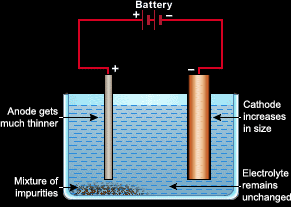
Elektroliz, metalleri rafine etmek için kullanılabilir. Örneğin, rafine etmek istediğimiz saf olmayan bir bakır örneğimiz varsa, bunu yapmak için benzersiz bir elektroliz hücresi kurarız.
- Katot saf bakırdan yapılacaktır.
- Anot, saf olmayan bakır numuneden yapılacaktır.
- Elektrolit, bir bakır tuzu ( bakır sülfat / nitrat ) çözeltisi olacaktır
Pil açıldığında, saf olmayan bakır numunesindeki delokalize elektron denizi pil tarafından emilecektir. Saf olmayan bakır daha sonra bakır iyonlarına dönüşecek ve elektrolite düşecektir. Şimdi elektrolit, bakır tuzundan ve anottan gelen bakır iyonlarına sahiptir. Elektronlar katoda ulaştığında, anottan düşen bakır iyonları katoda çekilecek ve elektronlarını atomlara dönüşerek geri alacaktır.
Anot yavaş yavaş incelir ve bakır iyonları düştüğü için kaybolur.
Katot büyür çünkü anotun bakırı ona çekilir.
Elektrolit değişmeden kalır.
Anotun safsızlıkları hücrenin dibine yerleşecektir.
Bu nedenle, genel olarak, bir metali rafine etmek için elektroliz hücresi aşağıdaki gibi kurulmalıdır:
- Katot, rafine edilecek metalin saf bir örneğidir
- Anot, rafine edilecek saf olmayan numunedir
- Elektrolit, aynı metalin bir tuz çözeltisidir ( tercih edilen bir nitrat veya sülfat )
Galvanik:
Elektrokaplama, metal bir nesnenin elektroliz yoluyla başka bir metalle kaplanmasıdır.
Elektrokaplamanın amaçları şunlardır:
- Nesneye korozyondan koruyucu bir tabaka vermek için
- Nesneye parlak, daha iyi bir görünüm kazandırmak için
Elektrokaplama hücresi fikri, rafinasyona çok benzer:
- Anot, elektrolizle kaplanacak metaldir.
- Katot, elektrolizle kaplanacak nesnedir
- Elektrolit, metalin elektrolizle kaplanacak bir tuz çözeltisidir.
Akım açıldığında, anotun metalinin atomları iyon haline gelecek ve çözeltiye düşecektir. Elektronlar dış devrede anottan katoda aktarılır. Elektronlar katoda ulaştığında, elektrolitteki metal iyonları, onu tamamen kaplayan nesnenin yüzeyine çekilir ve böylece elektrolizle kaplanır.
- Not:
- Elektrolizle kaplanacak nesne, metalin tüm nesneyi sıkıca kaplamasına izin vermeyecek lekeleri çıkarmak için zımpara kağıdı ile ovulmalı ve temizlenmelidir
- Elektrolizle kaplanacak nesne tamamen elektrolite batırılmalı ve tüm nesnenin düzgün bir şekilde kaplandığından emin olmak için sürekli döndürülmelidir.
- Elektrolizle kaplanacak nesne bir elektrik iletkeninden yapılmalıdır.
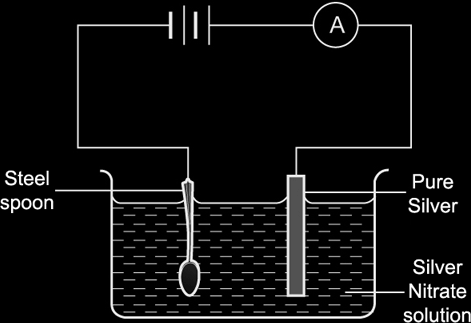
Örnek:
Çelik bir çatalı gümüşle elektrolizle kaplamak istiyorsak:
- Anot saf bir gümüş örneği olacaktır,
- Katot çatal olacak,
- Elektrolit bir gümüş nitrat çözeltisi olacaktır.
Anot:
Denklem: Ag – e- → Ag+
Gözlem: İncelir.
Katot:
Denklem: Ag+ + e- → Ag
Gözlem: Gümüş tabaka ile kaplanır, boyutu artar.
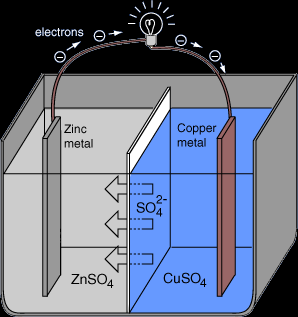
Basit Kimyasal Hücre:
Basit bir hücre, kimyasal enerjiyi elektrik enerjisine dönüştüren bir sistemdir. Basit bir hücre, biri diğerinden daha reaktif olan, bir tel ile birbirine bağlanmış ve bir elektrolite batırılmış iki metalden ( elektrot ) yapılır. İki elektrot arasına bir ampul takılırsa yanar.
Hücre bir çinko elektrot ve sülfürik aside batırılmış bir bakır elektrottan oluşuyorsa, şu şekilde çalışır:
- Çinko, bakırdan daha reaktiftir, elektronlarını çok daha kolay kaybeder. Elektronlar teller aracılığıyla çinko elektrottan bakır elektrota hareket eder, çinko atomları iyon haline gelir ve elektrolitin içine düşer,
- Elektronlar her zaman anottan katoda doğru hareket eder, bu yüzden çinko elektrot anot ve bakır elektrot katot diyeceğiz,
- Çinko, elektron verdiği için hücrenin negatif kutbudur, bakır hücrenin pozitif kutbudur ve onları alır,
- Sülfürik asit elektrolitinden H+ iyonları katoda ( bakır ) çekilir ve boşaltılır. Hidrojen gazı gelişir,
- Elektronların negatif kutuptan ( anot, çinko ) pozitif kutba ( katot, bakır ) hareketi, ampul gibi cihazlarda kullanılan bir elektrik akımına neden olur.
Negatif kutupta ( Çinko Anot ):
Denklem: Zn - 2e- → Zn+2
Gözlem: Anot incelir
Pozitif kutupta ( Bakır Katot ):
Denklem: 2H+ + 2e- → H2
Gözlem: Renksiz gaz kabarcıkları.
H+ iyonları bittiğinde veya anot tükendiğinde ampulün parlaması durur.
İki metal arasındaki reaktivite farkı ne kadar büyükse, üretilen voltaj o kadar büyük olur.