Moleküllerin Hücre Zarı Boyunca Taşınması
Moleküllerin Hücre Zarı Boyunca Taşınması
- BİLİM ve TEKNOLOJİ
- Mon, 1 Apr 2024 23:52:35
- Mon, 1 Apr 2024 23:52:35
Aşağıdaki noktalar, moleküllerin hücre zarı boyunca taşınmasında yer alan beş süreci vurgulamaktadır. Süreçler şunlardır: 1. Pasif Difüzyon 2. Kolaylaştırılmış Difüzyon 3. Aktif Taşıma 4. Grup Translokasyonu 5. İyonoforlar Yoluyla İyon Taşınımı.
1. Pasif Difüzyon:
Pasif difüzyon ile moleküller, hücre zarındaki herhangi bir spesifik taşıyıcı protein ile etkileşime girmeden zar boyunca hareket eder. Hareket her zaman daha yüksek bir konsantrasyondan daha düşük bir konsantrasyona doğrudur ve bu hareket, zarın her iki tarafındaki çözünen konsantrasyonu aynı olana kadar devam eder.
Bu konsantrasyonda bir dengeye ulaşılır. Bununla birlikte, hücre içindeki molekül tüketilirse, içe doğru hareket devam eder, örneğin hücreye taşınan oksijen solunum için sürekli olarak tüketilir veya fotosentez için karbondioksit tüketilir. Pasif difüzyon ile hücrelere girebilen moleküller genellikle küçük boyutludur ve doğada polar değildir.
2. Kolaylaştırılmış Difüzyon:
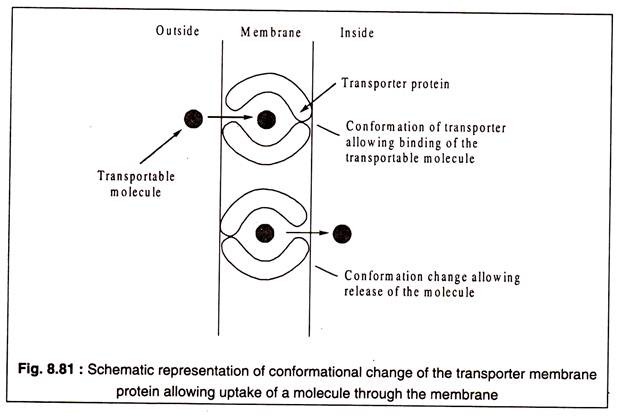
Bu taşıma işlemi, bir taşıyıcı veya taşıyıcı protein gereksinimine sahip olması bakımından pasif difüzyondan farklıdır. Geçirgenlik olarak da bilinen bu proteinler zarda bulunur ve lipit-çift tabakanın tüm genişliği boyunca yayıldığına inanılır.
Taşıyıcı proteinler, belirli bir molekül türüne veya bazen yakından ilişkili moleküllerden oluşan bir gruba özgüdür. Taşıyıcıların işlevi, taşınabilir molekülü zarın bir tarafına bağlamak ve diğer tarafına bırakmaktır. Muhtemelen, bu işlev, taşıyıcı protein molekülünün konformasyonel değişimi ile ilişkilidir.
Bu, Şekil 8.81'de şematik olarak gösterilmiştir:
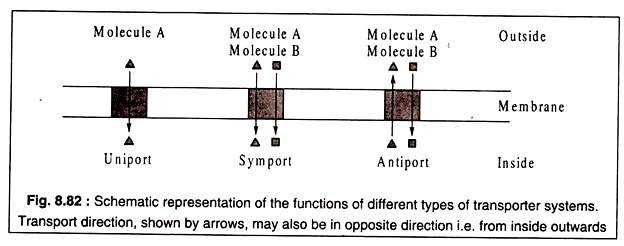
Üç tip taşıyıcı protein tanınmıştır. Bunlar, yalnızca bir tür molekülü tek bir yönde, dışarıdan içeriye veya ters yönde taşıyan tek taşıyıcılardır. Sempatikler iki farklı molekül türünü aynı yönde taşıyabilir; ve anti-taşıyıcılar zıt yönlerde iki farklı molekül taşırlar.
Bu üç tip taşıyıcının işlevleri Şekil 8.82'de şematik olarak gösterilmiştir:
Taşıma proteinleri bir dereceye kadar enzimlere benzer. Hem taşıyıcılar hem de enzimler, etkileşime girebilecekleri molekül veya molekül grubu ile ilgili özgüllük veya seçicilik gösterir. Ayrıca, her ikisi de bir doygunluk kinetiği sergiler, bu da reaksiyona girdikleri moleküllerin konsantrasyonunun kademeli olarak artmasıyla bir doygunluk noktasına ulaşıldığı anlamına gelir, bunun ötesinde daha fazla artış, hızda hiçbir artışa neden olmaz. Ancak önemli bir fark var. Enzimler substrat moleküllerini ürünlere dönüştürürken, taşıyıcı proteinler molekülleri zar boyunca değişmeden iletir.
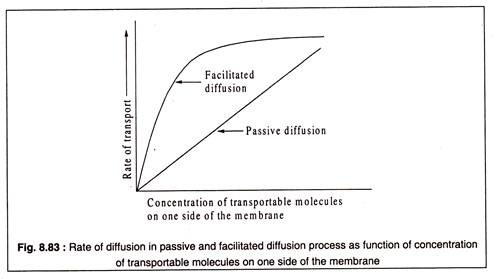
Kolaylaştırılmış difüzyon durumunda gözlenen satürasyon kinetiği pasif difüzyonda yoktur. Pasif difüzyonda, belirleyici faktör konsantrasyon gradyanıdır ve zarın iki tarafındaki taşınabilir moleküllerin konsantrasyonlarındaki farkla taşıma hızı artar.
Dengeye ulaşıldığında, konsantrasyonlar iki tarafta aynıdır. Kolaylaştırılmış difüzyon durumunda, zarın bir tarafındaki taşınabilir moleküllerin konsantrasyonundaki artış, tüm taşıyıcı proteinler bu tür moleküllerle doyurulana kadar taşıma hızında da bir artışa neden olur.
Bu noktada, difüzyon hızı maksimumdur ve bu oran, her iki taraftaki konsantrasyonlar eşit olana kadar korunur. Böylece, hem pasif difüzyon hem de kolaylaştırılmış difüzyon ile nihai konsantrasyon aynıdır. Ancak kolaylaştırılmış difüzyon daha hızlı bir süreç olduğundan, dengeye daha hızlı ulaşılır.
Bu, Şekil 8.83'te şematik olarak gösterilmiştir:
3. Aktif Taşıma:
Besin moleküllerinin aktif taşınması, temel olarak pasif veya kolaylaştırılmış difüzyon süreçlerinden farklıdır. Aktif proseste, membran boyunca taşıma, konsantrasyon gradyanına karşı, yani daha düşük bir konsantrasyondan daha yüksek bir çözünen madde konsantrasyonuna doğru gerçekleşir. Böyle bir taşıma ancak enerji harcaması ile gerçekleşebilir. Başka bir deyişle, aktif taşıma her zaman enerji tüketen ( endergonik ) bir süreçtir. Biyolojik sistemlerde, aktif taşıma genellikle difüzyon süreçlerinden çok daha önemlidir.
Çözünen moleküllerin daha düşük bir konsantrasyondan daha yüksek bir konsantrasyona aktif olarak taşınmasının enerji girdisi gerektirmesinin nedeni termodinamik prensiplerden anlaşılabilir. Hücredeki çözünen moleküllerin konsantrasyonundaki artış nedeniyle, entropi ( S ) azaldığı için serbest enerji ( G ) artar.
Serbest enerji ( ∆G ) değişimleri ile entropi arasındaki ilişki, ∆G = ∆H – T∆S denklemi ile ifade edilir, burada H entalpiyi ( sistemin toplam enerjisi ) ve T mutlak sıcaklığı temsil eder. Hücrede konsantrasyon arttıkça entropi düşer çünkü çözünen moleküller birbirine yaklaştırılır ve bu da hareket serbestliklerini kaybetmelerine neden olur.
Diğer faktörlerin, yani H ve T'nin aynı kalması, S'deki azalma, G'nin yani serbest enerjinin değerindeki artış anlamına gelir. Böylece, aktif taşıma serbest enerjide ( G ) kazanca yol açar. Serbest enerjide artışa yol açan bir süreç kendiliğinden gerçekleşemez ve ancak enerji girişi ile gerçekleşebilir. Bu enerji, ya ATP hidrolizi ya da zarın her iki tarafında eşit olmayan proton konsantrasyonu ( H ) tarafından üretilen proton hareket kuvveti ( PMF ) ile sağlanır.+
Aktif taşımada gereken enerji miktarı ( kalori olarak ifade edilir ) AG = RT In C2/C1 denklemi kullanılarak hesaplanabilir. Burada ∆G serbest enerjideki farkı temsil eder, gaz sabitidir ( = 1.98 ), T mutlak sıcaklık ( 273+°C ) olarak ifade edilen sıcaklık, Doğal logaritmada ( 2.303 x log10 ), C2 hücre içindeki çözünen maddenin konsantrasyonu ve Q dışarıdaki çözünen maddenin konsantrasyonu.
Şimdi, aktif taşımada C2 C1'den büyüktür ve dolayısıyla C2/C1 faktörü her zaman pozitif bir tamsayıdır. Bu, ∆G'nin pozitif bir değere sahip olduğu anlamına gelir. Pozitif ∆G'ye sahip bir sistem kendiliğinden çalışamaz. Yukarıdaki denklemden, belirli bir sıcaklıkta, örneğin 30°C'de 0,001 M ila 0,1 M konsantrasyonda, çözünen moleküle geçirgen olan bir zar boyunca 1 mol iyonize olmayan bir çözünen maddenin taşınması için gereken enerji miktarı hesaplanabilir;
∆G = RT In C2/C1 = 1,98 x (273+30) x 2,303 günlük (0,1/0,001)
= 1.98 x 303 x 2.303 x 2
= 2,763.3 cal
= 2.76 Kcal'dir.
Yüklü moleküller, yani iyonlar ve radikaller için, yukarıdaki denklem, konsantrasyon gradyanının yanı sıra başka bir gradyanı, yani elektro-potansiyel gradyanı barındıracak şekilde değiştirilmelidir, çünkü ikincisi aynı zamanda sistemdeki serbest enerji değişimine de katkıda bulunur.
Kolaylaştırılmış difüzyon gibi, aktif taşıma da hücre zarında bulunan taşıyıcı proteinlerin aracılığını içerir. Bu proteinler muhtemelen kolaylaştırılmış difüzyonda yer alanlarla aynı şekilde işlev görür. Taşınabilir çözünen madde için yüksek bir afiniteye sahip olmaları nedeniyle, onunla birleşirler ve böylece zarın diğer tarafında salınmaya neden olan çözünen moleküller için afiniteyi kaybeden konformasyonel bir değişikliğe uğrarlar.
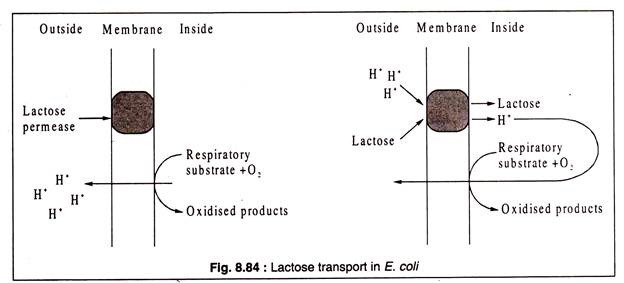
Belirli bir çözünen maddenin proton hareket kuvveti kullanılarak aktif olarak taşınması gerektiğinde, taşıyıcı protein hem H'yi hem de çözünen molekülleri bağlar. Bu tür taşımanın bir örneği, E. coli tarafından laktoz alımı ile sağlanır. Laktoz taşıyıcı ( laktoz geçirgenliği ) hem H hem de laktoz moleküllerini bağlar ve aynı anda hücreye taşır ( symport ).++
Başka bir örnek, E. coli'de glutamat taşınması durumunda bulunur. Bu durumda taşıyıcı, glutamat'ı dışarıya bağlar ve içeriye taşır ve H'yi içeriye bağlar ve onları dışarıya atar ( anti-port ), böylece glutamat alımı H tahliyesi ile bağlantılıdır.++
( i ) E. coli'de laktozun aktif taşınması:
E. coli'de laktoz taşınması indüklenebilir bir sistemdir. Laktoz yokluğunda üreyen bakteriler, şekeri hücrelere taşıyamaz. Ancak, diğer şekerlerin ( glikoz gibi ) yerini alan ortama laktoz eklendiğinde, bakteriler yeni laktoz geçirgenliği sentezi nedeniyle laktozu taşıma yeteneğini hızla geliştirir. Bu enzim, laktoz taşıyıcısı olarak işlev gören bir zar integral proteinidir.
Laktozun hücre içine taşınmasının, H iyonlarının tükenmesi nedeniyle dış ortamın pH değerinde bir artışa eşlik ettiği gözlemlenmiştir. Kemiozmotik teoriye göre, solunum substratlarının oksidasyonu, ATP sentezi için kullanılan hücre zarı boyunca bir proton gradyanı oluşturarak H'nin hücre dışına atılmasına yol açar. Bu şekilde oluşturulan proton gradyanı, E. coli tarafından laktoz alımı için de kullanılır.++
Laktoz geçirgenlik molekülü, laktozu bağlamak için belirli bir bölge ve H'yi bağlamak için başka bir bölge içerir ve enzimin işlevsel olması için her iki bölgenin de devreye girmesi gerekir. Permaz proteini zar boyunca yayılır ve dış yüzünde hem laktozu hem de protonu bağlar.+
Bu bağlanma, proteinin konformasyonunda bir değişikliğe neden olur ve hücre içinde hem laktoz hem de H'nin salınmasına neden olur ( symport ). Serbest bırakıldıktan sonra, geçirgenlik orijinal konformasyonuna geri döner ve döngünün tekrarlanmasına izin verir. Proton gradyanı, solunum H-atılımı ile korunur.++
E. coli'de laktoz geçirgenliğinin işlevi şematik olarak Şekil 8.84'te gösterilmiştir:
( ii ) Na ve K++'nin taşınması:
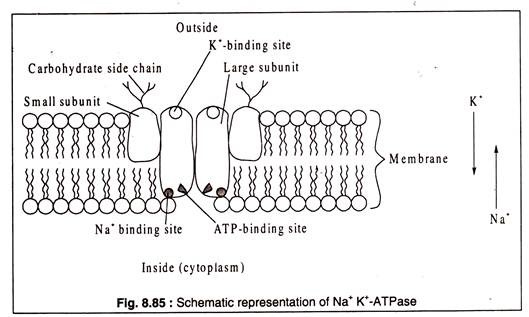
Çoğu biyolojik organizmada, hücre içi K konsantrasyonu dış ortamınkinden daha yüksektir. Na durumunda durum tersidir. Hücrelerin dış ortama karşı böyle bir diferansiyel Na ve K konsantrasyonunu koruma yeteneğinin, zarda bulunan bir enzim olan NaK-ATPaz'dan kaynaklandığı bulunmuştur.++++++
Bu enzimin işlevsel hale gelmesi için hücre içinde Na'nın ve hücre dışında K'nin bulunmasını gerektirir. Bir ATP bağlanma bölgesi ve Na'yı iç yüzüne doğru bağlamak için başka bir yeri vardır. Dış yüzünde, enzim bir K-bağlanma bölgesine sahiptir. Enzimin Na ve ATP'yi bağladığı için, konformasyonel değişikliğine neden olan bir ATP hidrolizini indüklediği öne sürülmüştür.+++ ++
Değiştirilmiş enzim konformasyonu, dışarıda salınan Na için afinitesini kaybeder; ancak aynı zamanda değişen konformasyon, hücre içinde taşınan K için afinite geliştirir. K'nin enzimle bağlanması, enzim proteininin orijinal konformasyonunu geri getiren ve Na ve ATP'nin bağlanmasına izin veren defosforilasyona ( inorganik fosfat salınımı ) neden olur. Saflaştırılmış bir Na K- ATPaz, iki büyük ve iki küçük alt birimden oluşan bir glikoproteindir.+++ +++
Küçük alt birimlerin dış yüzlerinde karbonhidrat yan zincirleri bulunur ( Şekil 8.85 ):
Na'nın Na K-ATPaz aktivitesi ile aktif olarak atılması, birçok mikroorganizma tarafından amino asitlerin ve şekerlerin aktif alımı için kullanılan membran boyunca bir Na gradyanı oluşturur. Bu bileşiklerin içe doğru taşınmasına, bir konsantrasyon gradyanını aşağı doğru hareket ettiren Na'nın eşzamanlı alımı eşlik ederken, amino asitler ve şekerler bir konsantrasyon gradyanına karşı, yani daha düşük ( dış ) bir konsantrasyondan daha yüksek ( iç ) bir konsantrasyona doğru hareket eder.+++++
Na'nın daha yüksek dış konsantrasyonu, Na'nın Na K-ATPaz aktivitesi yoluyla aktif olarak atılmasıyla korunur. Amino asitlere veya şekerlere özgü taşıyıcı proteinler, biri Na ve diğeri amino asit veya şeker için olmak üzere iki bağlanma bölgesine sahiptir. Sadece her iki bölge de ilgili ligandlar tarafından işgal edildiğinde, taşıma gerçekleşebilir ( symport ).+++++
4. Grup Translokasyonu:
Grup translokasyonu, taşınabilir molekülün sitoplazmik zardan geçişi sırasında kimyasal olarak geçirimsiz bir forma dönüştürüldüğü bir taşıma türüdür. Dönüşüm nedeniyle, molekül sitoplazmada sıkışır ve kaçamaz.
Grup translokasyonunun en iyi bilinen örneği, şekerlerin taşınması için çok çeşitli bakterilerde meydana gelen fosfotransferaz sistemidir ( PTS ). Sistemin E. coli, Salmonella, Vibrio, Staphylococcus, Clostridium, Fusobacterium vb. Bununla birlikte, Azotobacter, Mycobacterium, Nocardia ve Micrococcus gibi bazı bakterilerde PTS yoktur.
Farklı şekerlerin grup translokasyon sisteminde en az üç farklı proteinin yer aldığı bulunmuştur. Glikoz gibi bazı şekerler için ek bir protein gereklidir. Bu proteinler enzim I, enzim II ve HPr adı verilen ısıya dayanıklı küçük bir proteindir. Glikoz için ek protein enzim III'tür.
Enzim II hariç tüm bu proteinler sitoplazmiktir. Enzim II, zar integrali bir proteindir. Farklı şekerlerin taşınması için de farklıdır, enzim I ve HPr ise tüm şeker taşıma sistemlerinde ortaktır. Bu proteinler, PTS'de bir taşıyıcı zinciri görevi görür.
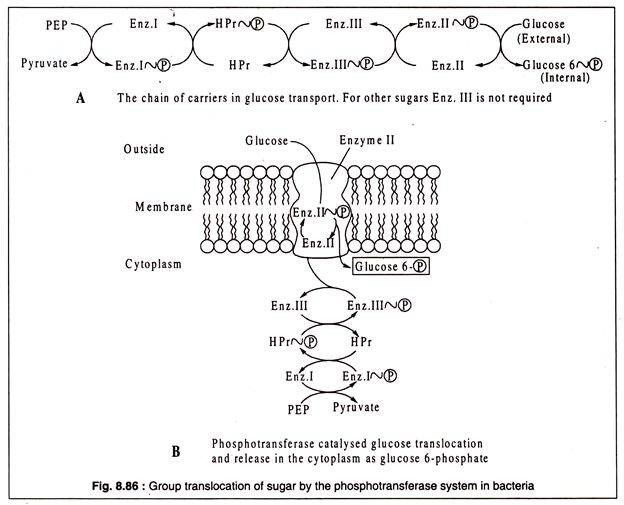
Bu translokasyon sisteminin ( PTS ) çalışması, fosfoenol pirüvik asidin ( PEP ) yüksek enerjili fosfat grubunun bakteri hücresinin sitoplazmasındaki enzim I'e ( E-I ) aktarılması ile başlar. Daha sonra, fosforile edilmiş EI'nin ( HIP ) fosfat grubu, HPr-( P ) üretmek için yine bir sitoplazmik protein olan HPr'ye aktarılır. Fosfat grubu daha sonra doğrudan membrana bağlı enzim II ( E-II )'ye veya glikoz taşınması durumunda enzim III ( E-III ) aracılığıyla aktarılır.
Son olarak, fosforile E-II veya E-III, fosfat grubunu taşınan şekere bağışlar ve şeker, fosfat esteri olarak sitoplazmada salınır. Örneğin, glikoz durumunda, glikoz 6-fosfattır. Negatif yüklü şeker fosfatın sitoplazmik zardan kaçması engellendi.
Mannitol durumunda, salındığı fosforile form mannitol-1-fosfattır. Membran genellikle yüklü moleküllere karşı geçirimsiz olduğundan, PTS sitoplazmada yüksek şeker fosfat konsantrasyonuna yol açabilirken, dış ortamda şeker konsantrasyonu çok daha düşüktür. Böylece, PTS'de şekerler bir konsantrasyon gradyanına karşı yer değiştirir. Bu nedenle, enerjinin enerji açısından zengin bileşik PEP tarafından sağlandığı bir tür aktif taşımadır.
Enzim II, taşınan şekere özgü zar integrali bir proteindir. PTS ile birçok farklı şeker türü taşınabilir. Bunlar arasında glikoz, galaktoz, fruktoz, pentoz, mannitol, ribitol ve galaktozitler gibi şeker alkolleri bulunur. Bu bileşiklerin her biri için farklı bir enzim II var gibi görünmektedir.
PTS'nin küçük ısıya dayanıklı proteini ( HPr ) 9.400 Dalton'luk bir moleküler ağırlığa sahiptir. HPr, E-I~( P ) tarafından fosforile edildiğinde, fosfat grubu, HPr'nin bir histidin kalıntısının bir N-atomu aracılığıyla bağlanır.
Bakterilerin fosfotransferaz sisteminin çalışmasındaki taşıma zincirinin şematik bir gösterimi Şekil 8.86'da gösterilmiştir:
5. İyonoforlar Yoluyla İyon Taşınması:
Mikro tarafından detaylandırılan bazı antibiyotik bileşikleri
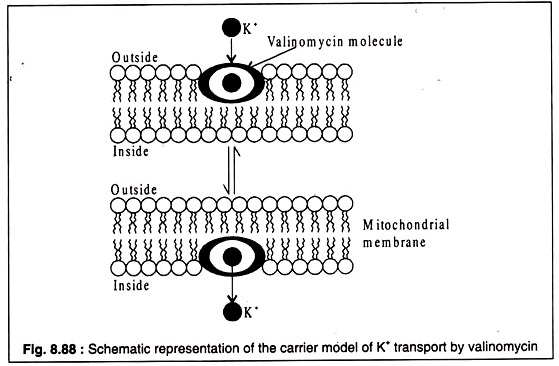
NISM'ler, membrana entegre edildiklerinde iyonofor görevi görebilirler. Bununla birlikte, bu ajanlar, zarın doğal taşıma bileşenleri değildir. Bu tür ajanlardan ikisi, bir Streptomyces türü tarafından üretilen valinomisin ve Bacillus brevis tarafından üretilen gramicidin'dir. İyonların bu iyonoforlar tarafından taşınması, izole mitokondride iyi çalışılmıştır.
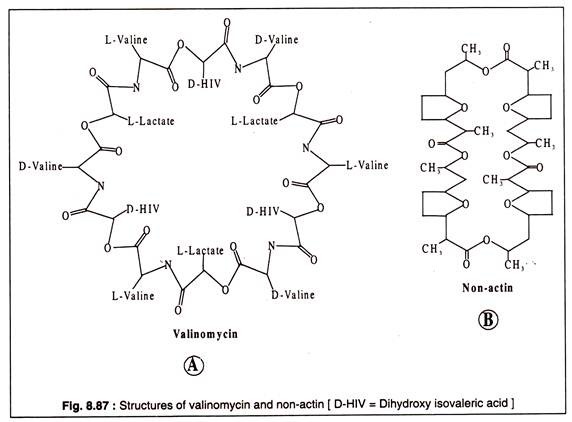
Valinomisin, 12 alternatif D- veya L-valin ve L-laktat veya D-hidroksiizovalerat molekülünden oluşan siklik bir moleküldür. Valinomisinin yapısı Şekil 8.87A'da gösterilmiştir. Dairesel valinomisin molekülü, valinomisinin yerleştirildiği zarın hidrfobik lipid çift tabakası ile iyi eşleşen hidrofobik bir çevreye sahiptir.
Valinomisin molecille'in merkezi çekirdeği hidrofiliktir ve negatif yüklüdür. Negatif yüklü çekirdek, pozitif yüklü katyonları bağlayabilir. Valinomisin özellikle K'yi taşıyabilir, çünkü boyutu merkezi çekirdeğe sıkıca oturacak şekildedir. Na veya Li, valinomisin tarafından daha az verimli bir şekilde taşınır, çünkü boyutları molekülün merkezi çekirdeğinin boyutuyla eşleşmez.+++
Başka bir antibiyotik bileşiği olan aktin olmayan, aynı zamanda dairesel bir yapıya sahiptir ve Kacross mitokondriyal membranı taşıdığı bilinmektedir.+
Yapısı Şekil 8.87B'de gösterilmiştir:
Bir hipoteze göre, valinomisin bir taşıyıcı görevi görür ve molekül, K'yi zar boyunca taşıyan zar lipid çift tabakası boyunca ileri geri yayılır.+
İyonun pozitif yükü, valinomisin molekülünün negatif yüklü çekirdeği tarafından maskelenir ( Şekil 8.88 ):
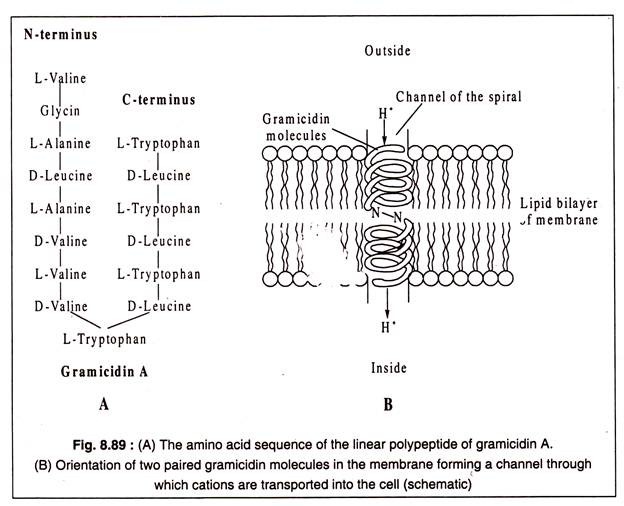
Gramicidin A, 15 amino asit kalıntısından oluşan doğrusal bir zincirden oluşan bir polipeptit antibiyotiktir. N-terminal uçlarında H-bağları ile birleştirilen iki gramicidin molekülü, zar boyunca uzanan bir sarmal oluşturur. Sarmalın merkezi kanalı boyunca, H, NH+4+, K, Na gibi tek değerlikli katyonlar ve Limay hücreye taşınır.+++
Taşınabilir iyonların tercih sırası belirtildiği gibidir, yani Hhas en yüksek tercih ve Li en düşük tercihtir.+ +
Gramicidin A molekülünün yapısı ve zarın lipid çift tabakasında bir çift gramicidin molekülü tarafından oluşturulan varsayılan sarmal Şekil 8.89 A ve B'de gösterilmiştir: